
科目: 来源: 题型:
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.使用催化剂可以改变化学反应的反应热
C.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为氢氧化钠
D.反应2CO(g) =2C(s) + O2(g) H>0可以自发进行
查看答案和解析>>
科目: 来源: 题型:
下列有关用水杨酸和乙酸酐制备阿司匹林(乙酰水杨酸)的说法中不正确的是
A.阿司匹林分子中有1个手性碳原子
B.水杨酸和阿司匹林都属于芳香族化合物
C.可用FeCl3溶液检验阿司匹林中是否含有未反应完的水杨酸
D.1 mol阿司匹林最多可与2 mol的NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中正确的是
A.上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1
B.图中V1 >20 mL
C.a点对应的溶液中:c (CH3COO-)=c (Na+)
D.当加入NaOH溶液的体积为20 mL时,溶液中:c(CH3COOH) + c (H+)>c (OH-)
查看答案和解析>>
科目: 来源: 题型:
短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是
A.在地壳中,C元素的含量位于第一位
B.A、B、D三种元素形成的化合物一定是强酸
C.C元素位于元素周期表中的第3周期第ⅠA族
D.B元素与氢元素形成化合物的化学式一定为H2B
查看答案和解析>>
科目: 来源: 题型:
我国新建的某海岛发电示意图如图,已知铅蓄电池放电时的总反应为:Pb+PbO2+2H2SO4= 2PbSO4+2H2O,下列有关说法正确的是
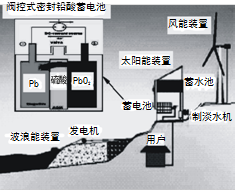
A.图中涉及的能量转化方式只有3种
B.蓄电池供电时,负极的电极反应为:Pb+SO42―-2e-=PbSO4
C.储能时若充电时间过长,阳极流向阴极的气体可能是H2
D.该发电工艺可实现零排放
查看答案和解析>>
科目: 来源: 题型:
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:CH2=CH2(g) + H2O(g) ![]() CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
A.合成乙醇的反应一定为吸热反应
B.目前工业上采用250~300℃,主要是在此温度下乙烯的转化率最大
C.目前工业上采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率
D.相同催化剂下,在300℃ 14.7MPa乙醇产率反而比300℃ 7MPa低得多,是因为加压平衡向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:阅读理解
(12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤ ▲ 。
⑥ ▲ 。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生: ▲ 。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是: ▲ 。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10−39)。下列说法正确的是 ▲ (选填序号)。

a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是: ▲ 。
(5)补充上述步骤⑤和⑥(可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸)。
查看答案和解析>>
科目: 来源: 题型:
(10分)综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤ ▲ ;⑥加适量的盐酸;⑦ ▲ 。
(2)溶液Ⅱ中发生反应的化学方程式是: ▲ 。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用 ▲ 溶液进行洗涤以除之。
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式 ▲ 。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为: ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(8分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g)H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是 ▲ 。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l)H2O(l)+H2NCONH2(l) △H2
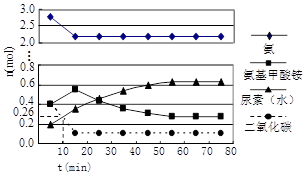
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,
图Ⅰ 图Ⅱ
实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 ▲ 步反应决定,总反应进行到 ▲ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= ▲ 。
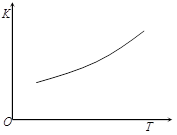
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ▲ 0(填“>”“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com