
科目: 来源: 题型:
将AgCl分别加入盛有:①5 mL水;② 6 mL 0.5 mol/L NaCl溶液;
③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L 盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A.④③②① B.②③④① C.①④③② D.①③②④
查看答案和解析>>
科目: 来源: 题型:
NA表示阿伏加德罗常数。下列说法正确的是
A.7.8 g Na2O2中含有的阴离子数目为0.2 NA
B.标准状况下,2.24 L CHCl3的分子数为0.1 NA
C.1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2 NA
D.9.2 g NO2和N2O4的混合气中含有的氮原子数为0.2 NA
查看答案和解析>>
科目: 来源: 题型:
某原电池装置如图所示。下列有关叙述中,正确的是
A.Fe作正极,发生氧化反应
B.负极反应: 2H+ + 2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al +2OH-= 2AlO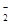 + H2↑
+ H2↑
B.碳酸钙溶于醋酸中:CaCO3 + 2H+= Ca2+ + CO2↑+ H2O
C.氯气通入NaOH稀溶液中:Cl2+ 2OH-= Cl-+ ClO-+ H2O
D.Ba(OH)2溶液与过量NaHSO4溶液混合:H+ + SO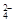 + Ba2+ + OH-= BaSO4↓+ H2O
+ Ba2+ + OH-= BaSO4↓+ H2O
查看答案和解析>>
科目: 来源: 题型:
已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是
A.溶液的质量 B.Ca(OH)2的溶解度
C.溶液中Ca2+离子的数目 D.溶液中溶质的质量分数
查看答案和解析>>
科目: 来源: 题型:
将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) +B(g) 2C(g) ΔH<0。
4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
查看答案和解析>>
科目: 来源: 题型:
常温下,有浓度均为0.1 mol/L的4种溶液:①盐酸;②硫酸;③醋酸;
④氢氧化钡。(注:忽略溶液混合时体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号) 。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是 。
查看答案和解析>>
科目: 来源: 题型:
氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始
浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,CO的平衡转化率为 。
查看答案和解析>>
科目: 来源: 题型:
现有3种化合物A、B、C均含短周期元素R,其转化关系如下图所示。
(1)若A由第三周期2种元素组成。常温下,0.1 mol/L X溶液的pH=13,则R在周
期表中的位置是 ,X中阴离子的电子式是 ,B转化为C的离子方程式是 。
(2) 若常温下A、B、C、X均为气态物质,1mol A中含有共价键的数目约为1.806×1024, X为单质,A与X反应生成B的化学方程式是 ;在一定条件下,
A可与C反应消除C对大气的污染,该反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO![]() 离子,加入下列沉淀剂的顺序是(填序号) 。
离子,加入下列沉淀剂的顺序是(填序号) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水反应的离子方程式是 。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是 。
(5)纯碱在生产生活中有广泛的应用。
① 纯碱可用于除灶台油污。其原因是(结合离子方程式表述) 。
② 常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。
则反应前的溶液中与反应后的滤液中水电离出的c(OH—)的比值是 。
③ 工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是 。(已知碳酸的酸性强于次氯酸)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com