
科目: 来源: 题型:
某无色溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种。①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③向淀粉溶液中滴加橙黄色溶液未变蓝色。根据上述实验事实推断,在该溶液中肯定存在的离子组是 ( )
A.Na+、 I-、SO32- B.Fe2+、I-、SO32-
C.Na+、Br-、CO32- D.Fe2+、Br-、CO32-
查看答案和解析>>
科目: 来源: 题型:
几种短周期元素的原子半径及主要化合价见下表:
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.080 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
根据表中信息,判断以下说法正确的是 ( )
A.单质与稀硫酸反应的速率快慢:R>Y>X
B.离子半径:T2->X2+
C.元素最高价氧化物的水化物的碱性:Y > R >X
D.单质与氢气化合的难易程度:Z>T
查看答案和解析>>
科目: 来源: 题型:
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
将一定量的锌与100mL 18.5 mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 16.8L(标准状况)。将反应后的溶液稀释到1 L,测得溶液的pH=0,则下列叙述中错误的是( )
A.反应中共转移电子1.5mol B.反应中共消耗锌65 g
C.气体A为SO2和H2的混合物 D.气体A中SO2和H2的体积比为4∶1
查看答案和解析>>
科目: 来源: 题型:
10分)A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 ;工业上制取A的离子方程式为 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是 。
(4)若D空气质量预报必报的气体,A、B、C的的焰色反应都呈黄色,则可以证明B是否变质的一组试剂是 (请写出试剂名称)。
查看答案和解析>>
科目: 来源: 题型:
(12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是
(2)Z、W形成的气态氢化物的稳定性 > (写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式 。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过
一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a 、b 推知B溶液中含有的离子为 ;
②B的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
(14分)实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
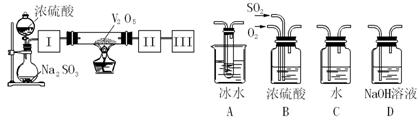
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为 。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ ,装置Ⅱ ,装置Ⅲ 。
(3)开始进行实验时,首先应进行的操作是 。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会 (填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是 (用含字母的代数表示)。
查看答案和解析>>
科目: 来源: 题型:
(18分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[FeSO4·7H2O]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的是 。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有 和玻璃棒;其中玻璃棒的作用是 。
(3)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是 、 。
(4)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、 、冷却结晶、 、自然干燥。其中“加热通氧气”所起的作用为 (用离子方程式表示)。
![]() (5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===CuSO4+xH2O ,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验过程中,称量操作至少进行 次。若测定结果x值偏高,可能的原因是 。
(5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===CuSO4+xH2O ,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验过程中,称量操作至少进行 次。若测定结果x值偏高,可能的原因是 。
a.加热温度过高 b.加热时胆矾晶体飞溅出来
c.加热后放在空气中冷却 d.所用坩埚事先未干燥(潮湿)
查看答案和解析>>
科目: 来源: 题型:
化学在人类生活中扮演着重要角色,以下应用正确的是
A.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的
B.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂
C.使用无磷洗衣粉,可彻底解决水体富营养化问题
D.天然药物无任何毒副作用,可长期服用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com