
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
物质的加热是中学化学实验的重要基本操作.常用加热方式有3类:①直接在酒精灯上加热;②通过石棉网用酒精灯加热;③通过水浴加热.以下10个中学化学实验中有的要加热,有的不要加热.
A.用双氧水和二氧化锰制取氧气
B.食盐溶液蒸发制取氯化钠晶体
C.氯化铵与碱石灰反应制取氨气
D.浓硝酸和铜反应制取二氧化氮气体
E.乙醇和浓硫酸制取乙烯
F.石油的分馏
G.苯与溴在铁催化下制取溴苯
H.乙醛溶液与银氨溶液发生银镜反应
I.乙酸乙酯在酸性条件下发生水解
J.葡萄糖与新制的氢氧化铜悬浊液反应
其中:
(1)可用酒精灯直接加热的有(填写字母代号,多选倒扣分,下同)______.
(2)用酒精灯通过石棉网加热的有______.
(3)通常用水浴加热的有______.
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
A、B、C、D、E是中学化学中五种常见元素,有关信息如下
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)A的氢化物分子的电子式是______,其水溶液能使酚酞变红的原因用电离方程式解释为:______.
(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:______,证明存在该阳离子.
(3)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为______.
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:______.
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)E制品通常在潮湿空气中发生电化学腐蚀,该过程的正极反应式为______.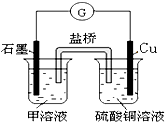
(6)若在D与E组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极出现的现象是______,负极的反应式为:______.
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上的强热至恒重,然后对加热后固体进行元素定性定量分析,确定固体组成与Na2SO3无异;但把加热后固体溶于水,得到的溶液pH值比Na2SO3溶液的pH高.
(1)Na2SO3溶液呈______性(填“酸”或“碱”),其原理是(以相关的离子方程式表示)______.
(2)强热后的物质是什么呢?同学作如下探究
①分析猜想:Na2SO3在强热下发生了分解反应(自身氧化还原反应)
②该残留物可能的存在物质:
假设1:______;
假设2:______.
③设计实验方案证明你的假设,请按下表格式完成相关内容.(限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、试管夹;6mol?L-1 HCl、0.1mol?L-1BaCl2、0.1mol?L-1KCl、蒸馏水)
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解 | 固体全部溶解 |
| 步骤2: | |
| 步骤3 |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题




查看答案和解析>>
科目: 来源: 题型:解答题
已知NaHS04是一种酸式盐,在工业上应用广泛,根据NaHS04的性质回答下列问题:
(1)写出NaHS04在水溶液中的电离方程式:______
(2)若向NaHS04溶液中滴加Ba(OH)2至SO42-完全沉淀时的离子方程式为______
(3)滴加Ba(0H)2溶液使溶液呈中性时的化学方程式为______
(4)若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为______
(5)一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6L(标准状况下)的气体,则该合金中铝、铁的物质的量之比为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com