
科目: 来源: 题型:
(14分)现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: C 、H
(2)写出反应③的离子方程式:
写出反应⑦的离子方程式:
(3)实验室检验物质G中阳离子的常用试剂是:
实验室检验物质D中阳离子的方法是
(4)分析反应,3H2O2 + 2H2CrO4= 2 Cr(OH)3 + 3O2 + 2H2O
该反应中的还原剂是___ ________,,还原产物是______ ____;
若该反应转移了0.3mol电子,则产生的气体在标准状态下体积约为_____ ___。
查看答案和解析>>
科目: 来源: 题型:
(12分)已知某纯碱(Na2CO3)试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将a g试样放人锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的U型管的质量,得到b g;
④从分液漏斗滴人6 mol·L-1的硫酸,直到不再产生气体时为止;
⑤从导管A处缓缓鼓人一定量的空气;
⑥再次称量盛有碱石灰的U型管的质量,得到c g;
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g;
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将 (填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
查看答案和解析>>
科目: 来源: 题型:
(14分)欲用浓硝酸法测定某铜银合金中铜的质量分数(测定反应后生成气体的量),但资料表明:①反应中除生成NO2气体外还有少量NO生成;②常温下NO2和N2O4混合存在,在低于0℃时,几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计了如图所示的实验装置。
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___。
(2)装置中B瓶的作用是 。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是__ __。
(4)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是 。
(5)C装置烧瓶中的物质是 ,用简单的实验证实你的判断: 。
(6)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是____________________________。
查看答案和解析>>
科目: 来源: 题型:
(12分)电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)提取纯Al2O3做冶炼铝的原料,某研究性学习小组设计了如下提取流程图
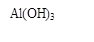
(1)固体Ⅱ的化学式为_ ,该固体的颜色为 ;
(2)在实际工业生产流程⑤中需加入冰晶石,目的是 ;
(3)写出流程③的离子方程式 ;
(4)铝粉与氧化铁粉末在引燃条件下常用来焊接钢轨,主要是利用该反应 ;
(5)从铝土矿中提取铝的过程不涉及的化学反应类型是 ;
A.复分解反应 B.氧化还原反应 C.置换反应 D.分解反应
(6)生产过程中除NaOH、H2O可以循环使用外,还可以循环使用的物质有_ _;
(7)若向滤液Ⅰ中逐滴滴入NaOH溶液至过量,产生沉淀随NaOH滴入关系正确的是
查看答案和解析>>
科目: 来源: 题型:
NA代表阿伏加德罗常数,下列说法正确的是( )
A.1molMgCl2中含有的离子数为2NA
B.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.0.1mol/L稀硫酸中含SO42-的数目为0.1NA
D.标准状况下,11.2LNO和5.6LO2混合后,分子总数小于0.5NA
查看答案和解析>>
科目: 来源: 题型:
下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀
D.浓的硫化钠溶液有臭味
查看答案和解析>>
科目: 来源: 题型:
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是( )
A. △H1>△H2>△H3 B. △H1<△H3<△H2 C. △H1<△H2<△H3 D.△H1>△H3>△H2
查看答案和解析>>
科目: 来源: 题型:
下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是( )
A. ⑥③①②⑤④ B. ⑤①②⑥④③ C. ⑤④③②①⑥ D.③①②④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
对于0.1mol·L-1的Na2S溶液,下列判断正确的是 ( )
A.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-)
B.c(Na+)=2c(S2-)+c(OH-)+c(HS-)
C.向Na2S溶液中加水稀释,其所有离子的浓度都减小
D.向溶液中加入少量NaOH固体,能促进水的电离
查看答案和解析>>
科目: 来源: 题型:
下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时可用金属铜做阳极
D.电解稀硫酸制H2和O2时铜做阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com