
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
科目: 来源: 题型:单选题
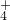 、NO
、NO 、Al3+、Cl-
、Al3+、Cl- 、NO
、NO 、Na+
、Na+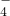 、K+、SO
、K+、SO 、Na+
、Na+ 、HCO
、HCO 、Na+
、Na+查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | ______ | 固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含______ |
查看答案和解析>>
科目: 来源: 题型:填空题
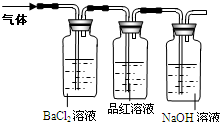 工业上常通过高温分解FeSO4的方法制备Fe2O3,但同时有污染环境的气体产生,为搞清这种气体的组成,进行如下的探究:
工业上常通过高温分解FeSO4的方法制备Fe2O3,但同时有污染环境的气体产生,为搞清这种气体的组成,进行如下的探究:查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
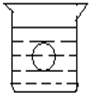 如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同).试回答:
如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同).试回答:查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com