
科目: 来源: 题型:
下列物质性质的变化规律与分子间作用力有关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、Nal的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
查看答案和解析>>
科目: 来源: 题型:
下列关于杂化轨道的叙述中,不正确的是( )
A.分子中中心原子通过SP3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子
C.H2SO4硫酸分子中三种原子均以杂化轨道成键
D.N2分子中N原子没有杂化,分子中有一个σ键、2个π键
查看答案和解析>>
科目: 来源: 题型:
下表为元素周期表前四周期的一部分,下列关于R、W、X、Y、Z五种元素的叙述中正确的是( )
A.W元素的第一电离能小于Y元素的第一电离能
B.Y、Z的阴离子电子层结构都与R原子的相同
C.最高价含氧酸的酸性,Y对应的酸性强于W
D.P亚层未成对电子最多的是Z元素
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.可燃冰晶体中(8CH4·46H2O)CH4与H2O 分子之间以及H2O 与H2O 间都以氢键结合
B.氨气易液化,是因为氨分子之间存在氢键
C.含有阳离子的晶体一定是离子晶体
D.金属晶体的熔沸点一定比分子晶体高
查看答案和解析>>
科目: 来源: 题型:
关于下列几种离子晶体,说法不正确的是( )
A.由于NaCl晶体和CsCl晶体中正负离子半径比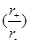 不相等,所以两晶体中离子的配位数不相等
不相等,所以两晶体中离子的配位数不相等
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4不相等,主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2高主要是因为MgO的晶体能比MgCl2大
D.MCO3中M2+半径越大,MCO3热分解温度越低
查看答案和解析>>
科目: 来源: 题型:
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是( )
A.(1)(3) B.(2)(3) C.(3)(4) D.只有( 4)
查看答案和解析>>
科目: 来源: 题型:
(9分)下表为周期表的一部分,其中的编号代表对应的元素。
(1)写出上表中的元素⑩原子的外围电子排布式 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为 杂化,元素⑦与⑧形成的化合物的晶体类型是 。
(3)元素④的第一离能 元素⑤(填“>”、“=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为 。
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。
(5)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,其离子方程式为
查看答案和解析>>
科目: 来源: 题型:
(12分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B、A与X均可形成10个电子的化合物:B与Z的最外层电子数之比2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。
请回答下列问题:
(1)Z的原子结构示意图 ;X原子核外电子排布式为 ;B元素原子的电子排布图 。
(2)A与Y可形成离子晶体的化合物,该化合物的电子式为 ,该化合物与A2X反应的化学方程式 。
(3)化合物Y2X2属于 化合物(“离子”或“共价”),其中含有化学键的类型是 。
(4)B与X可形成三原子化合物,构成该化合物晶体的粒子是 。粒子间的作用力是 。
(5)A与X,A与Z均能形成18个电子的极性分子化合物,此两种化合物的化学式分别是 和 。
查看答案和解析>>
科目: 来源: 题型:
(7分)(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是 (填符号),画出配合物离子![]() 中的配位键 。
中的配位键 。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com