
科目: 来源: 题型:单选题
 通入FeBr2溶液中:2Fe2++Cl2═2Fe3++2Cl-
通入FeBr2溶液中:2Fe2++Cl2═2Fe3++2Cl-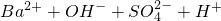 ═BaSO4↓+H2O
═BaSO4↓+H2O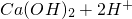 ═
═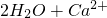
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 | 操作步骤 | 现象 |
| 1 | 取少量加碘食盐溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 2 | 取少量NaCl溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 3 | 取少量水… | 溶液变蓝 |
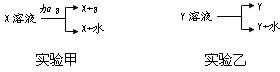
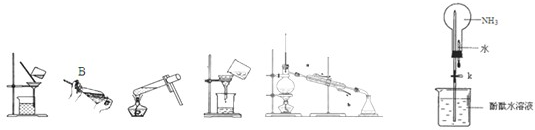
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

 化的曲线如右图所示.则NH4VO3在分解过程中______.
化的曲线如右图所示.则NH4VO3在分解过程中______.查看答案和解析>>
科目: 来源: 题型:单选题
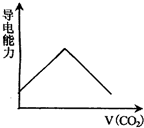
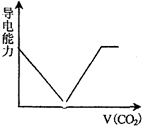
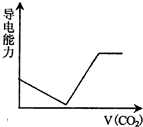
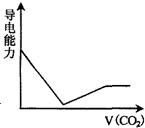
查看答案和解析>>
科目: 来源: 题型:解答题
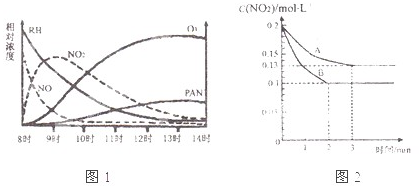
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com