
科目: 来源: 题型:
下列离子方程式中正确的是 ( )
A.用氯气作为水的消毒剂: Cl2+H2O = 2H++Cl-+ClO-
B.向AlCl3溶液中加入过量氨水:Al3+ + 4NH3• H2O AlO2-+4NH4+ + 2H2O
C.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:
Ba2+ + OH- + H+ +SO42- = BaSO4↓+ H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合: 2 I- + H2O2 + 2 H+ =2 H2O +I2
查看答案和解析>>
科目: 来源: 题型:
在aLNa2SO4和Fe2(SO4)3的混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-完全沉淀,加入足量强碱可得到cmol Fe(OH)3沉淀,则原溶液中Na+的浓度为 ( )
A. B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
下列在限定条件溶液中的各组离子,能够大量共存的是 ( )
A.pH=3 的溶液:Na+、Fe2+、Cl-、ClO-
B.在强碱性溶液中:Na+、Al3+、AlO2-、CO32-、SiO32-
C.使酚酞试液变红的溶液:Na+、Al3+、SO![]() 、Cl-
、Cl-
D.水电离的H+浓度为1×10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br-
查看答案和解析>>
科目: 来源: 题型:
右图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是 ( )
A.非金属性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.三种元素中,Y的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目: 来源: 题型:
下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g)2H2O(g);△H= —483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l);△H=-57.4kJ/mol
C.己知2C(s)+2O2(g)=2CO2(g);△H1 ;2C(s)+O2(g)=2CO(g);△H2 则△H1>△H2
D.在密闭容器中,发生化学反应:2NO(g)+2CO(g) N2(g)+2CO2(g);∆H= -QkJ/mol现充入NO和CO各4 mol 进行反应,反应结束时,反应放热2QkJ
查看答案和解析>>
科目: 来源: 题型:
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
该反应中还原产物是______________________;若反应过程中转移了0.2电
子,则氧化产物的质量是________________________。
(2)将过量Cl2 通入 FeBr2溶液中,反应的离子方程式为:________________________;
(3)向NH4HCO3溶液中滴加少量的NaOH溶液,反应的离子方程式为______________;
(4)观察如下反应,总结规律,然后完成下列问题:
Al(OH)3 +H2O Al(OH)4- + H+ NH3+H2O
NH4+ + OH-
①已知B(OH)3是一元弱酸,写出其电离方程式_____________________________
②N2H4是二元弱碱,写出其第二步电离方程式___________________ ____
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。
(1)D的原子结构示意图为__________________,丙的电子式为____________________,E在周期表中的位置为__________________________________。
(2)下列说法正确的有__________________________
① 化合物乙为正四面体形分子,是由极性键构成的非极性分子
② C、D、E、F原子半径由大到小的顺序为C> D >E> F
③ B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④ 化合物甲和化合物丙都含有离子键和共价键
(3)已知通常状况下1g F在空气中完全燃烧放出a kJ的热量,请写出表示F燃烧热的热化学方程式 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应_ ___。
(4)写出一个由以上元素构成的10e-微粒与18e-微粒反应的离子方程式:
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
|
已知:① A、B两溶液呈碱性,等物质的量浓度时,B溶液的碱性强于A溶液。
② C是酸,只与D产生沉淀。
③ A溶液与E溶液反应既有气体又有沉淀产生
试回答下列问题:
(1)分别写出A、B、C、D、E的化学式:A 、B 、C 、D 、E ;
(2)写出A、E反应的离子方程式: ;
(3)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中至反应完全,离子方程式为: 。
(4)在100 mL 0.1 mol·L-1 E溶液中,逐滴加入40 mL 1.6 mol·L-1 NaOH溶液,最终得到沉淀物质的量为____ mol。
查看答案和解析>>
科目: 来源: 题型:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①检查装置气密性
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
③装好实验装置。
④加热,开始反应,直到产生一定量的气体
⑤停止加热,测量收集到气体的体积
⑥准确称量试管和残留物的质量为b g。
⑦测量实验室的温度。
⑧处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性? 。
(2)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)。
(3)如果实验中得到的氧气体积是cL(25℃、1.0l×l05Pa,该条件下气体的摩尔体积为Vm).氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)= 。
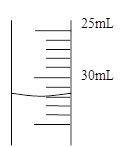 (4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(5)若计算所得结果比实际值偏大,则可能的原因是___________
A.氯酸钾中混有不产生氧气的固体杂质
B.第一次称量时药品、砝码反置
C.药品未完全分解
D.量筒内液体被排尽
E.装置漏气
F.读数时俯视量筒刻度
查看答案和解析>>
科目: 来源: 题型:
肉桂醛是一种实用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中.工业上可通过下列反应制备:
下列相关叙述正确的是
① B的相对分子质量比A大28;② A、B可用酸性高锰酸钾溶液鉴别;③ B中含有的含氧官能团是醛基、碳碳双键;④ A、B都能发生加成反应、还原反应;⑤ A能发生银镜反应; ⑥ B的同类同分异构体(含苯环、包括B)共有5种;⑦ A中所有原子一定处于同一平面
A.只有①②⑤ B.只有③④⑤ C.只有④⑤⑥ D.只有②⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com