
科目: 来源: 题型:
一定条件下,某密闭容器中充入等物质的量的A、B两种气体,发生反应:
A(g) + B(g)![]() 2C(g)。达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化如下两图所示。
2C(g)。达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化如下两图所示。
下列说法中正确的是
A.30min时减小容积
B.40min时加入催化剂
C.0~20min内A的平均反应速率为0.05mol·L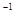 ·min
·min![]()
D.正反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是

A.电极B材料中包含MnO2层,MnO2可增强导电性
B.电池负极区的电极反应为:
BH4 + 8OH
+ 8OH![]() —8e
—8e![]() =BO
=BO![]() +6H2O
+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH2O2溶
液,理论上流过电路中的电子为6NA个
查看答案和解析>>
科目: 来源: 题型:
(15分)A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素,D的最外层电子数是其内层电子数的三倍。已知:①热稳定性:HmD>HmC;②![]() 、
、![]() 具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息回答下列问题:
具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息回答下列问题:
(1)![]() 的电子式:_____________。
的电子式:_____________。
(2)![]() 、
、![]() 的还原性强弱为_________>___________,能证明其还原性强弱的离子方程式为____________________________。
的还原性强弱为_________>___________,能证明其还原性强弱的离子方程式为____________________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式______________________________。
(4)A和E形成的化合物,其晶体类型属___________;该晶体中离A最近的A有_____个。A和E形成化合物的熔点比C和E形成化合物的熔点_________(填高或低)。
(5)常温下,将等物质的量浓度的![]() 溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为_______________。
溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为_______________。
查看答案和解析>>
科目: 来源: 题型:
(15分)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).
填写下列空白:
(1)长颈漏斗C中应加入___________;实验时,U型管B中应加入的试剂是_______。烧瓶D中发生的反应有时要加入少量硫酸铜溶液,其目的是_________________ 。
(2)试管F中发生反应的化学方程式是______________________________。
(3)实验进行时,烧瓶G的作用是__________________________;
烧瓶I的作用是___________________________。
(4)在A、D、F、G、I各仪器中,在实验时不需要加热的仪器是(填该仪器对应的字母)_____________。
(5)为了安全,在A管中的反应发生前,在E出口处必须_____________;A管中的反应开始后,在E出口处应 ___________________________。
查看答案和解析>>
科目: 来源: 题型:
(16分)肉桂醛在食品、医药化工等方面都有应用。
(1)质谱分析肉桂醛分子的相对分子质量为132。其分子中碳元素的质量分数为81.8%,其余为氢和氧。分子中的碳原子数等于氢、氧原子数之和。肉桂醛的分子式是____________。
(2)肉桂醛具有下列性质:
请回答:
①肉桂醛是苯的一取代物,苯环侧链上有三种不同化学环境的氢原子,其结构简式是 _______________________ 。
②Z不能发生的反应类型是 。
A.取代反应 B.消去反应 C.加成反应 D.加聚反应
③Y与乙醇在一定条件下作用得到肉桂酸乙酯,该反应的化学方程式是_____________。
④Y的同分异构体中,属于酯类且苯环上只有一个取代基的同分异构体有___________种,其中任意一种的结构简式是_______________________。
(3)已知
Ⅰ、醛与醛能发生反应,原理如下:
Ⅱ、合成![]() -甲基肉桂醛(C10H10O)的工业流程如下图所示(甲为烯烃):
-甲基肉桂醛(C10H10O)的工业流程如下图所示(甲为烯烃):
请回答:
①写出丙和丁生成![]() -甲基肉桂醛的化学方程式是______________________________。
-甲基肉桂醛的化学方程式是______________________________。
②醛和酯也可以发生如(3)Ⅰ类似的反应。食用香料肉桂酸乙酯可通过如下反应合成:
![]()
戊的结构简式是_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
(15分)工业上为了使原料和能量得到充分的利用,常常采用循环操作。
Ⅰ、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。
MnFe2O4的制备:
|
| 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 3.7 |
| Mn2+ | 8.3 | 10.4 |
已知Fe3+、Mn2+沉淀的pH如右表所示。
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质
的量之比应为 __________。
(2)控制pH的操作中m的值为 。
Ⅱ、用MnFe2O4热化学循环制取氢气:
![]()
![]()
(3)由上可知,表示H2燃烧热的热化学方程式是__________________________。
(4)该热化学循环制取氢气的优点是_______________(填字母编号)。
A.过程简单、无污染
B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
Ⅲ、工业上可用H2、HCl在一定条件下通过下图的循环流程制取太阳能材料高纯硅。
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是___________________。
查看答案和解析>>
科目: 来源: 题型:
21世纪是海洋世纪,海洋经济专属区的开发受到广泛重视,下列有关说法正确的是( )
A.海水含镁,将金属钠放入海水中可以制取金属镁
B.利用潮汐能发电是将化学能转化为电能
C.从海水中提取溴的过程涉及氧化还原反应
D.海底多金属结核矿含有Fe、Mn、Co、B等金属
查看答案和解析>>
科目: 来源: 题型:
设NA代表阿伏加德罗常数,下列说法正确的是( )
A.12 g NaHSO4在熔融时离子总数为0.3NA
B.28 g N60单质(见上图)中含有的N—N键个数为3NA
C.在25℃时,压强为1.01×105 Pa时,11.2 L氧气所含的原子数为NA
D.常温下,将5.6 g 铁投入足量的浓硫酸中转移电子数为0.3NA
查看答案和解析>>
科目: 来源: 题型:
下列实验方案能达到目的的是( )
A.除去Fe粉中混有的I2:加热使I2升华
B.除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶
C.除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶
D.除去氢氧化镁中混有的氢氧化钙:放入水中搅拌成浆状后,加入足量氯化镁溶液,加适量水过滤洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com