
科目: 来源: 题型:
在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A) =0.100mol/L、c(B) =0.200mol/L及c(C) =0mol/L。反应物A的浓度随时间的变化如图所示。请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
![]() ②__________ ____ _;
②__________ ____ _;
③ ;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的![]() _________0,判断其理由是______ ________;
_________0,判断其理由是______ ________;
(4)该反应进行到4.0min时的平均反应速度率(读数均保留两位有效数字):
实验②:![]() =__________________________________;
=__________________________________;
实验③:![]() =__________________________________。
=__________________________________。
查看答案和解析>>
科目: 来源: 题型:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的NaOH溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______ _________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图示,则所用盐酸溶液的体积为___ _____ mL。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________。
A.酸式滴定管未用标准液润洗就直接注入标准盐酸溶液
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请用上述数据计算该NaOH溶液的物质的量浓度。c(NaOH)= 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象;
乙:① 用pH计测定物质的量浓度均为0.1mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/25 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4 D.2 mol·L-1 HA
(3)pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
E.稀释后A溶液中水的电离程度比B溶液中水的电离程度小
查看答案和解析>>
科目: 来源: 题型:
已知:CO(g)+H2O(g) CO2(g)+H2(g) △H= -42kJ·mol-1
(1)在一定温度下,向一定体积的密闭容器中通入1molCO、2molH2O(g),反应达平衡时,测得放出的热量为28kJ,求CO的转化率为 ;
(2)该温度下,向该密闭容器中通入![]() molCO2、
molCO2、![]() molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是 ;
molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是 ;
(3)该温度下,向该密闭容器中通入2molCO、3molH2O(g),反应达平衡时时,求H2O(g)的转化率 ;
(4)该温度下,向该密闭容器中通入1.5molCO、3molH2O(g),反应达平衡时,放出的热量为 kJ。
查看答案和解析>>
科目: 来源: 题型:
小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有( )
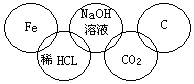
A、复分解反应、1个 B、分解反应、2个
C、化合反应、3个 D、置换反应、2个
查看答案和解析>>
科目: 来源: 题型:
在下列的例子中,是利用分散质粒子的大小不同达到分离的是( )
A.除去粗盐中不溶性的泥沙
B.煎熬中药时,用水在煮沸条件下,提取中药中可溶的有效成分
C.把石油经蒸馏分离成为汽油,煤油和柴油等
D.当水中混有较多油而分层时,用吸管可逐渐吸出上层的油
查看答案和解析>>
科目: 来源: 题型:
已知阿伏加德罗常数(NA)、物质的摩尔质量及摩尔体积,下列物理量中尚不能全部计算出其近似值的是 ( )
A.固体物质分子的大小和质量 B.液体物质分子的大小和质量
C.气体物质分子的大小和质量 D.气体物质分子的质量
查看答案和解析>>
科目: 来源: 题型:
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O
与上述反应在氧化还原原理上最相似的是 ( )
A.AlCl3+3NaAlO2+6H2O==4Al(OH)3↓+3NaCl B.2H2S+SO2==2H2O+3S
C.2NaBr+Cl2==2NaCl+Br2 D.2FeCl3+H2S==2FeCl2+S↓+2HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com