
科目: 来源: 题型:
在密闭容器中发生下列反应aA(g)cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.平衡向正反应方向移动 B.A的转化率变大
C.C的体积分数变大 D.a < c+d
查看答案和解析>>
科目: 来源: 题型:
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g) ![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 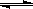 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
将体积都为10 mL、pH都等于3的醋酸和盐酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5。则稀释后溶液的体积( )
A. a=b=100 mL B. a=b=1000 mL C.a>b D.a<b
查看答案和解析>>
科目: 来源: 题型:阅读理解
实验室常利用甲醛法(HCHO)测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+消耗NaOH与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________________(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
| 滴定 次数 | 待测溶液的体积 /mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
滴定时消耗NaOH标准溶液的体积的平均值V=__________mL; 若NaOH标准溶液的浓度为0.1010 mol·L-1,则250 mL溶液中的n(NH4+)=__________mol,该样品中氮的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a. 氢气的浓度减少 b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加 d. 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
设水的电离平衡线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐酸的体积比为__________ 。
查看答案和解析>>
科目: 来源: 题型:
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,生成4mol z时放出热量Q KJ,它们的物质的量随时间的变化如表所示。
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(1)根据上表中数据,在答卷该题相应位置上画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2) 写出体系中发生反应的热化学方程式 ______;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:
(4) 该反应达到平衡时反应物X的转化率![]() 等于______________________;
等于______________________;
(5) 改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1 _____2_____3_____的曲线:
查看答案和解析>>
科目: 来源: 题型:
今有①盐酸 ②硫酸 ③醋酸三种酸:
(1)在同体积,同PH的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(2)在同体积、同浓度的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(3)物质的量浓度为0.1 mol·L—1的三种酸溶液的PH由大到小的顺序是____________ _;如果取等体积的0.1 mol·L—1的三种酸溶液,用0.1mol·L—1的NaOH溶液中和,当恰好完全反应时,消耗溶液的体积由大到小的顺序是____________ ___(以上均用酸的序号填写)。
查看答案和解析>>
科目: 来源: 题型:
下图表示的一些物质或概念间的从属关系中不正确的是( )
|
| X | Y | Z |
| A | 酸 | 化合物 | 纯净物 |
| B | 电解质 | 盐 | 化合物 |
| C | 胶体 | 分散系 | 物质 |
| D | 碱性氧化物 | 氧化物 | 化合物 |
查看答案和解析>>
科目: 来源: 题型:
.纳米材料是粒子直径为1—100nm的材料,其研究成果已应用于医学、化工、军事等领域。纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,下列有关形成的物质的判断正确的是( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸
⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
A.①②③④ B.②③⑤⑥ C.②③④ D.②③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com