
科目: 来源: 题型:
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s) Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50)。下列说法正确的是: ( )
A. 加入NaCl可以使溶液由a点变到b点
B. b点和d点均无AgCl沉淀生成
C. a点对应的Ksp大于c点对应的Ksp
D. 向0.1mol/L的硝酸银溶液中滴加0.1mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀。其沉淀转化的反应方程式为:2AgCl(s)+S2-(aq)Ag2S(s)+2Cl-(aq) 。
查看答案和解析>>
科目: 来源: 题型:
在常温下,将PH = 11 的某一元碱 BOH 溶液和PH=3 的某一元酸 HA 溶液等体积混合后,下列说法不正确的是( )
A.若所得溶液呈中性,则生成的盐可能为NaCl;
B.若所得溶液呈碱性,则可能是生成CH3COONa;
C.若所得溶液中[A+]=[B-],则反应后溶液一定呈中性;
D.若所得溶液的 PH=5 ,则可能是强碱与浓的弱酸溶液反应;
查看答案和解析>>
科目: 来源: 题型:
密闭容器中进行下列反应: M(g)+N (g)R(g)+2L 此反应符合下面图像,下列叙述是正确的是( )
A. 正反应吸热,L 是气体
B.正反应吸热,L是固体
C. 正反应放热,L是气体
D.正反应放热,L是固体或液体
查看答案和解析>>
科目: 来源: 题型:
在容积为1L的密闭容器中,充入1 mol N2和4 mol H2,一定条件下反应N2+3H2 2NH3 达到平衡,此时N2和H2的物质的量之比恰好为 1:5。试回答下列问题:
(1)平衡时混合气体的压强与起始时混合气体的压强相比 (填“偏高”、“偏低”或“相等”)。
(2)该平衡混合气中NH3的体积分数是 。
(3)平衡时,H2的转化率为
查看答案和解析>>
科目: 来源: 题型:
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu 64)。
按照实验步骤依次回答下列问题:
⑴ 导线中电子流向为 (用a、b 表示)。
⑵ 写出装置中锌电极上的电极反应式: ;
⑶ 若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(不许用“NA”表示 )
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+,Cl-的移动方向描述正确的是 。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D. 盐桥中的K+、Cl-几乎都不移动
⑸ 若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A.NaOH B. Zn C.Fe D. H2SO4
查看答案和解析>>
科目: 来源: 题型:阅读理解
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴ 写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵ 在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);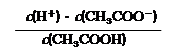
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L; 已知:lg1.3=0.114);
⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解。
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸ 物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹ 常温时,有以下3种溶液,其中pH最小的是
⑺ 已知醋酸能够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
查看答案和解析>>
科目: 来源: 题型:
向8 g某二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知所消耗稀硫酸的体积为100 mL,在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28g。
(1)根据计算确定金属氧化物的名称。
(2)计算通电后剩余的混合溶液中,硫酸的物质的量浓度(溶液体积按100mL计算)。
查看答案和解析>>
科目: 来源: 题型:
关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子 B.随核电荷数递增,氢氧化物碱性增强
C.随电子层数增加,原子半径增大,金属还原性增强
D.依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com