
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
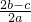
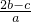
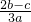
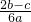
查看答案和解析>>
科目: 来源: 题型:解答题
下表中五个小实验,每个小实验有一项未填写,试按要求填空:
| 序号 | 要完成的实验 | 选用的试剂 | 原理(用化学方程式表示)或方法 |
| (1) | 由Al2O3冶炼Al | 加冰晶石 | |
| (2) | 由煤制取粗苯 | / | |
| (3) | 从溴水中提取Br2 | 萃取分液 | |
| (4) | 从I2和SiO2混合物中提取I2(固) | / | |
| (5) | 从海水中提取食盐 | / |
查看答案和解析>>
科目: 来源: 题型:解答题
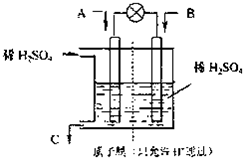 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.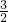 O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.
O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.查看答案和解析>>
科目: 来源: 题型:解答题
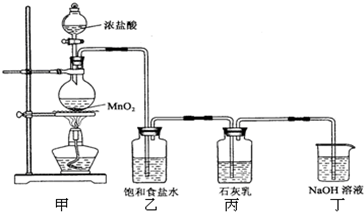
 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com