
科目: 来源: 题型:
(3分)将等体积的氨水与盐酸溶液混和后,若混和溶液中[NH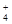 ]=[Cl-],则溶液中的pH值为______7,混和前[NH3·H2O]______[HCl],氨水中[OH-]______盐酸中[H+]。(填>、<或=,下同)
]=[Cl-],则溶液中的pH值为______7,混和前[NH3·H2O]______[HCl],氨水中[OH-]______盐酸中[H+]。(填>、<或=,下同)
查看答案和解析>>
科目: 来源: 题型:
(4分)(1)碳酸钾的水溶液蒸干得到的固体物质是________,原因是________________。
(2)KAl(SO4)2溶液蒸干得到的固体物质是________,原因是____________________。
(3)碳酸氢钡溶液蒸干得到的固体物质是________,原因是____________________。
(4)亚硫酸钠溶液蒸干得到的固体物质是________,原因是____________________。
(5)氯化铝溶液蒸干得到的固体物质是________,原因是______________________。
查看答案和解析>>
科目: 来源: 题型:
(5分)25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L溶液。
(1)该溶液中共含有________种不同的微粒(包括分子和离子);
(2)在这些微粒中,__________和__________两种微粒的物质的量之和等于0.01mol;
(3)________和___________两种微粒的物质的量之和比H+的物质的量多0.008mol。
查看答案和解析>>
科目: 来源: 题型:
(3分)浓度为0.1mol/L的8种溶液:①HNO3 ②H2SO4③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl溶液pH值由小到大的顺序是(填写编号)____________。
查看答案和解析>>
科目: 来源: 题型:
(9分)(1)体积相同,c(H+)相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率 ,充分反应后产生氢气的量 (相同、醋酸的多、盐酸的多),原因是 。
(2)在一定量的盐酸溶液中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入 晶体,理由是 ;要使产生氢气的量不变,但反应速率减慢,可加入 晶体,理由是 。
可供选择的晶体有:
A.纯碱 B.烧碱 C.胆矾 D.醋酸钠 E.KHSO4
查看答案和解析>>
科目: 来源: 题型:
某学生用0.1 mol/L的KOH标准溶液滴定未知浓度盐酸,其操作分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3 cm
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空
(1)正确操作步骤的顺序是(用序号字母填写)____________________________;
(2)上述B步骤操作的目的是________________________________________________;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是________;
(4)判断到达滴定终点的实验现象是_____________________________________;
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果产生的影响是____________________________________。
查看答案和解析>>
科目: 来源: 题型:
元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目: 来源: 题型:
已知2SO2+O2 2SO3为放热反应,对该反应的下列说法中正确的是
A.O2的能量一定高于SO2的能量 B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量 D.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目: 来源: 题型:
对化学反应限度的叙述,错误的是
A.任何可逆反应都有一定的限度 B. 化学反应的限度是不可改变的
C.化学反应的限度与时间的长短无关 D. 化学反应达到限度时,正逆反应速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com