
科目: 来源: 题型:
下列溶液中的各组离子,在一定条件下可能大量共存的是
A.加入Al能放出H2的溶液中:Ca2+、NH4+、ClO-、Cl-
B.含0.1mol/L NO3-的溶液中:H+、Fe2+、Mg2+、Br-
C.由水电离产生的c(H+)=10-13 mol/L的溶液中:Na+、K+、SO32-、AlO2-
D.无色透明的溶液中:Al3+、Na+、SO42-、HCO3-
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式与所述事实相符且正确的是
A.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
B.用双氧水和稀硫酸处理铜板:Cu+H2O2+2H+=Cu2++2H2O
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
D.铵明矾[AlNH4(SO4)2·12H2O]溶液中加入过量氢氧化钡溶液:
Al3++NH4++2SO42-+2Ba2++5OH-= AlO2-+2BaSO4↓+NH3·H2O+2H2O
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.100 mL pH=2的盐酸与醋酸溶液中氢离子数均为10-3NA
B.标准状况下,11.2 L C2H2和N2的混合气分子中σ键数目为0.5NA
C.常温常压下,4.6 g Na在O2中燃烧消耗O2的分子数为0.05NA
D.常温常压下,33.6 L氯气与27 g铝充分反应,转移电子数为3NA
查看答案和解析>>
科目: 来源: 题型:
用下列装置能达到有关实验目的的是
A.用甲图装置电解精炼铝
B.用乙图装置制备Fe(OH)2
C.用丙图装置可制得金属锰
D.用丁图装置验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目: 来源: 题型:
现有两种不含结晶水的盐,它们在不同温度下的溶解度如下表:
|
| 20℃ | 50℃ |
| A的溶解度 | 35.7 g | 46.4 g |
| B的溶解度 | 31.6 g | 108 g |
下列说法中,正确的是
A.可采用重结晶法使A、B混合物分离
B.A的溶解度一定大于B的溶解度
C.20℃时,无法配制30%的A的不饱和溶液
D.将208 g B的饱和溶液降温到20℃,析出76.4 g B
查看答案和解析>>
科目: 来源: 题型:
将过量的铝粉与FeO·2Fe2O3粉末配制成铝热剂,并分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体15.68 L(标准状况);另一份在高温下发生铝热反应,反应后的混合物与足量的盐酸反应,放出气体的体积(标准状况)可能为
A.11.20 L B.15.68 L C.22.40 L D.13.36 L
查看答案和解析>>
科目: 来源: 题型:
(10分)自然界钨主要以钨(+6)酸盐的形式存在,黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)。黑钨矿传统冶炼工艺流程图如下:
⑴写出上述第一步转化中生成MnO2的化学反应方程式 ▲ ;整个转化过程中黑钨矿被氧化的元素是 ▲ 。
⑵检验沉淀C是否洗涤干净的操作是 ▲ 。
⑶已知上述转化中W的化合价未发生变化,将产品D用碳或氢气还原均可得到钨,根据实际生产需要,请你选择合适的还原剂,说明理由: ▲ 。
⑷产品D有一种蓝色非整比的存在形态,其化学式为WO3-x,该化合物中存在五价和六价两种价态的钨。若x=0.1,则化合物中五价和六价的钨原子数之比为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(10分)下图为一些常见物质的转化关系图(部分反应物与生成物未标出)。A、C、E、G为单质,其中A、C、G为金属,E为气体。B为常见无色液体,L为红褐色固体,I的焰色反应呈紫色。常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质。
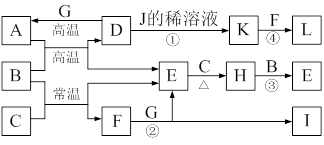
⑴A在元素周期表中的位置为 ▲ ,H的电子式为 ▲ 。
⑵写出有关反应的离子方程式:
反应①的离子方程式为 ▲ 。
反应②的离子方程式为 ▲ 。
⑶反应③中每生成1 mol E,转移电子的物质的量为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(10分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K。工业上制备无水FeCl3的一种工艺如下:

⑴取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片得红褐色氢氧化铁胶体,其离子方程式可表示为: ▲ ,胶体粒子的直径一般不超过 ▲ 。
⑵吸收塔中吸收剂X是 ▲ 。
⑶温度超过673 K,捕集器中的物质相对分子质量为325,该物质的分子式为 ▲ 。
⑷通常用碘量法测定FeCl3的质量分数:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶,用蒸馏水定容;取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去V mL。则样品中氯化铁的质量分数为: ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com