
科目: 来源: 题型:
锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉行涂覆在铝箔上)进行资源回收研究,设计实验流程如下:

⑴第②步反应得到的沉淀X的化学式为_____。
⑵第③步反应的离子方程式是______。
⑶第④步反应后,过滤Li2CO3所需的玻璃仪器有_______。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
_________。
⑷若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0mL 3.0 mol·L-1的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有______g Na2CO3参加了反应。
查看答案和解析>>
科目: 来源: 题型:
 |
⑴A→B的反应类型是______,D→E的反应类型是____,E→F的反应类型是____。
⑵写出满足下列条件的B的所有同分异构体
_____ (写结构简式)。
① 含有苯环 ②含有酯基 ③能与新制Cu(OH)2反应
⑶C中含有的官能团名称是_____。已知固体C在加热条件下可溶于甲醇,下列C→D的有关说法正确的是_________。
a.使用过量的甲醇,是为了提高D的产率 b.浓硫酸的吸水性可能会导致溶液变黑
c.甲醇既是反应物,又是溶剂 d.D的化学式为C9H9NO4
⑷E的同分异构体苯丙氨酸经聚合反应形成的高聚物是___________(写结构简式)。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
⑴Y位于周期表第_____周期第_____族,Y和Z的最高价氧化物对应的水化物的酸性较强的是_______(写化学式)。
⑵XY2是一种常用的溶剂,XY2的分子中存在__个σ键。在H-Y、H-Z两种共价键中,键的极性较强的是________,键长较长的是_______。
⑶W的基态原子核外电子排布式是_。W2Y在空气中煅烧生成W2O的化学方程式是___。
⑷处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(s) + ![]() O2(g) = XO2(g) ΔH = -283.0 kJ ·mol-1
O2(g) = XO2(g) ΔH = -283.0 kJ ·mol-1
Y(s) + O2(g)= YO2(g) ΔH = -296.0 kJ ·mol-1
此反应的热化学方程式是__。
查看答案和解析>>
科目: 来源: 题型:
将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③>④ D.①=②>③=④
查看答案和解析>>
科目: 来源: 题型:
右图是三种稀酸对Fe – Cr合金随Cr含量变化的
 腐蚀性实验结果,下列有关说法正确的是
腐蚀性实验结果,下列有关说法正确的是
A.稀硝酸对Fe – Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:
Fe + 6HNO3(稀) == Fe(NO3)3+ 3NO2↑ + 3H2O
C.Cr含量大于13%时,因为三种酸中 硫酸的氢离子浓度最大,所以对Fe – Cr合金的腐蚀性最强
硫酸的氢离子浓度最大,所以对Fe – Cr合金的腐蚀性最强
D.随着Cr含量的增加,稀硝酸对Fe – Cr合金的腐蚀性减弱
查看答案和解析>>
科目: 来源: 题型:
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:

请回答下列问题:
(1) 硫酸与二氧化钛反应的化学方程式是____________________________________。
(2) 向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3) 在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
查看答案和解析>>
科目: 来源: 题型:
(13)已知:
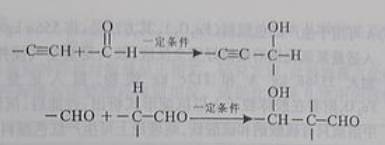
以乙炔为原料,通过下图所示步骤能合成有机中间体E(转化过程中的反应条件及部分产物已略去)。
![]()
其中,A,B,C,D分别代表一种有机物,B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1) A生成B的化学反应类型是____________________________。
(2) 写出生成A的化学反应方程式_________________________________________。
(3) B在浓硫酸催化下加热,可生成多种有机产物。写出2种相对分子质量比A小的有机产物的结构简式:_________________、__________________。
(4) 写出C生成D的化学反应方程式:
__________________________________________________________________。
(5)含有苯环,且与E互为同分异构体的酯有______种,写出其中一种同分异构体的结构简式:____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶
于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质
 碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用
方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为 ;阴极上观察到的实验现象是 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I—。请设计一个检验电解液中是否有I—的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 | 实验现象及结论 |
|
|
|
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
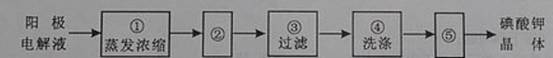
步骤②的操作名称是 ,步骤⑤的操作名称是 。步骤④洗涤晶体的目的是
。
查看答案和解析>>
科目: 来源: 题型:
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质A的元素位于周期表中第 周期,第 族。
(2)B与氢氧化钠溶液反应的化学方程式为:
。
(1) G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为
,当生成2 二氧化氯时,转移电子
二氧化氯时,转移电子 ![]() 。
。
(2) 溶液F在空气中长期放置生成H的化学反应方程式为:
。
(3) H的溶液与稀硫酸反应产生的现象为
。
查看答案和解析>>
科目: 来源: 题型:
反应aM(g)+bN(g) ![]() cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
 A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加
A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加
B.同压同Z时,升高温度,平衡时Q的体积分数增加
C.同温同Z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加Z,平衡时Q的体积分数增加。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com