
科目: 来源: 题型:
某实验小组用氨碱法制取碳酸钠的原理,在实验室设计下列模拟装置制备NaHCO3(铁架台、C装置水浴中的温度计、酒精灯等略去),然后再制取Na2CO3。提供的试剂有:硫酸、盐酸、石灰石、浓氨水、碳酸氢钾溶液、水、生石灰、食盐等。

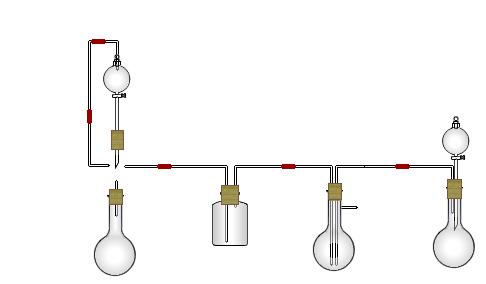
(1)在A中分液漏斗和烧瓶中加入的试剂分别是 、 ;D中分液漏斗和烧瓶中加入的试剂分别为 、 ;
(2) B中加入的试剂是 , 作用是 。
(3)写出C中生成的NaHCO3化学方程式: 。
(4)装置A中分液漏斗上方装一导管的主要作用是 。
(5)实验开始a、b两活塞的正确操作应是(选填序号) 。
①同时打开a、b两活塞 ②先打开a,后打开b ③先打开b,后打开a
(6)检验C装置溶液中生成的溶质是NaHCO3而不是Na2CO3的方法是 。
(7)由C中NaHCO3再制取Na2CO3需进行的实验操作有过滤、洗涤、 。
(8)从绿色化学角度看,这一装置的主要缺点是尾气逸出,浪费资源,
|
查看答案和解析>>
科目: 来源: 题型:
工业上用CO生产燃料甲醇。一定条件下发生反应:CO (g)+2H2 (g)![]() CH3OH(g)。
CH3OH(g)。

(1)该反应的平衡常数表达式为:K=
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)= 。
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,反应的热化学方程式是 。
(4)适宜的催化剂能 (选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率 d.提高反应物的转化率
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有 (选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2
查看答案和解析>>
科目: 来源: 题型:
已知硝酸与金属反应时,在不同条件下有不同的还原产物,甚至在同一反应中可同时得到多种还原产物。现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质,
(1) 请利用其中五种物质组成一个完整的化学反应,写出该化学反应方程式:
;
(2)上述所写反应中,硝酸表现出的化学性质是 ,被还原的元素是 。
(3)若六种物质组成一个完整的化学反应,则反应中的还原产物是 (填化学式),若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为 。
(4)若六种物质组成一个完整的化学反应,且没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是 。
查看答案和解析>>
科目: 来源: 题型:
下表中所列的是六种短周期元素原子的半径及主要化合价:
| 元素代号 | A | B | C | D | E | G |
| 原子半径/nm | 0.089 | 0.071 | 0.117 | 0.16 | 0.074 | 0.082 |
| 主要化合价 | +2 | -1 | +4,-4 | +2 | -2 | +3 |
(1)C元素在周期表中的位置为 ;E原子的电子填充在 个轨道上,这些电子有 种不同的能量。
(2)B、D、E所代表元素的离子半径从大到小的顺序为 (填离子符号)。
(3)C与E形成的化合物属于 晶体。
(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式: 。
(5)已知X是与E同族的另一短周期元素,有人认为:H—E键的键能大于H—X键的键能,所以H2E的沸点高于H2X的沸点。你是否赞同这种观点 (填“赞同”或“不赞同”),理由: 。
查看答案和解析>>
科目: 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.加入合金的质量可能为6.4g B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为150mL D.溶解合金时收集到NO气体的体积为2.24L
查看答案和解析>>
科目: 来源: 题型:
常温下,海水在浓缩过程中析出盐的种类和质量(表中为每升海水析出的各种盐的克数,单位g/L)如下表:
| 海水密度 (g/mL) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 |
|
|
|
|
| 1.20 | 0.91 |
|
|
|
|
| 1.21 | 0.05 | 3.26 | 0.04 | 0.008 |
|
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 |
|
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 |
| 1.40 | 0.54 | 0.03 | 0.06 |
海水从密度为1.21 g/mL浓缩到密度为1.22g/mL时发生的变化是
A.各种盐的溶解度增大 B. 海水中水的质量分数减小
C.析出的粗盐中 NaCl的质量分数增大 D. 海水中Br-浓度不变
查看答案和解析>>
科目: 来源: 题型:
vmL密度为![]() g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
A.C=![]() B.C=
B.C=![]() C.W%=
C.W%=![]() D.m=
D.m=
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式中,错误的是
A. 氯气通入硝酸银溶液中:Cl2+H2O+Ag+→AgCl↓+H++HClO
B. 用硫酸铜溶液吸收硫化氢气体:Cu2+ + S2-→ CuS↓
C. 次氯酸钠溶液中通入少量二氧化碳 ClO-+ H2O+ CO2 → HCO3-+ HClO
D. 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-→ BaCO3↓+CO32-+2H2O
查看答案和解析>>
科目: 来源: 题型:
以下反应中,Q1>Q2 的是
A.S(s)+O2(g)![]() → SO2(g)+ Q1 kJ; S(g)+O2(g)
→ SO2(g)+ Q1 kJ; S(g)+O2(g)![]() → SO2(g)+ Q2 kJ
→ SO2(g)+ Q2 kJ
B.2H2(g)+O2(g)![]() → 2H2O(l)+Q1 kJ;2H2(g)+O2(g) → 2H2O(g)+Q2 kJ
→ 2H2O(l)+Q1 kJ;2H2(g)+O2(g) → 2H2O(g)+Q2 kJ
C.NaOH(aq)+HCl(aq)![]() → NaCl(aq)+H2O(l)+Q1 kJ
→ NaCl(aq)+H2O(l)+Q1 kJ
NaOH(aq)+HAc(aq) →NaAc(aq)+H2O(l)+Q2 kJ
D.H2(g)+Cl2(g)![]() → 2HCl(g)+Q1 kJ, H2(g)+F2(g)
→ 2HCl(g)+Q1 kJ, H2(g)+F2(g)![]() → 2HF(g)+Q2 kJ
→ 2HF(g)+Q2 kJ
查看答案和解析>>
科目: 来源: 题型:
将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20mL气体,再将该气体用足量水吸收,剩余2.10mL气体(气体体积在同温同压下测定),则杂质不可能
A.只是NaNO3 B. 只是AgNO3 C. 只是NaCl D.是NaNO3和AgNO3的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com