
科目: 来源: 题型:
聚-3-羟基丁酸酯(PHB)可用于制造可降解塑料等。PHB是由许多3-羟基丁酸分子聚合而成,合成聚-3-羟基丁酸酯的途径有很多,其中一种途径的副产品少、污染小、原子利用率高,其合成路线如下:
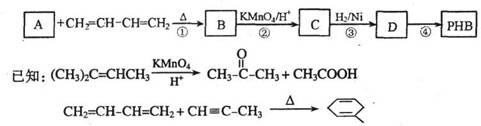
请回答下列问题:
(1)写出C中含有的官能团的名称:__________________。
(2)上述转化过程中属于加成反应的是________________(填序号)。
(3)反应②符合绿色化学思想(碳原子的有效利用率为100%),则A的结构简式为
_________________________。
(4)写出与C互为同分异构体,能发生银镜反应,且核磁共振氢谱有两个吸收峰的有机物的结构简式:_____________________________。
(5)反应④的化学方程式为_____________________________________________________。
(6)4-羟基丁酸钠(HOCH2CH2CH2COONa)是一种麻醉药。现以上述合成路线中的C物质为原料制取4-羟基丁酸钠,请写出其合成路线流程图(合成过程中无机试剂任选,并注明反应条件)。
提示:由乙醇制取聚乙烯的合成路线流程图可表示为:
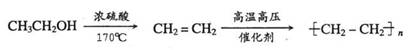
查看答案和解析>>
科目: 来源: 题型:阅读理解
随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5mol·L-1时通常认为该离子沉淀完全)。
| 金属离子 | Ksp | pH(10-1mol·L-l) | pH(10-5mol·L-l) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
| Ca2+ | 4.0×10-5 | 12.3 | 14.3 |
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol·L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是_______________________________。
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
①Cr2O72-转变为Cr3+的离子方程式为_______________________________。
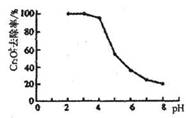 ②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:____________________________________________。
②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在______范围内对降低废水中的铬含量最有利,请说明理由:____________________________________________。
[注:去除率(%)=[(c0-c)/co]×100%,
式中:co—理前废水中Cr2O72-的浓度,
c—处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用。例如,用Na2C03溶液可
以将锅炉水垢中的CaS04转化为较疏松而易清除的CaC03,该沉淀转化达到平衡时,其平衡常数K=_________(写数值)。[已知Ksp (CaS04)=9.1x10-6,Ksp (CaC03)=2.8x10-9]
查看答案和解析>>
科目: 来源: 题型:阅读理解
近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_________________________________。
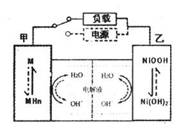 (2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:
![]()
根据所给信息判断,混合动力车上坡或加速时,乙电极周围
溶液的pH将_______(填“增大”、“不变”或“减小”),该
电极的电极反应式为_________________。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
CO(g)+1/2O2(g) ![]() CO2(g)。
CO2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编号 | c(CO)/mo1·L-1 | c (02)/mol·L-1 | c (C02)/mol·L-1 | v(正)和v (逆) 比较 |
| I | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol·L-l和1.0×10-4mol·L-l。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中C0的浓度为_________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250~300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下:
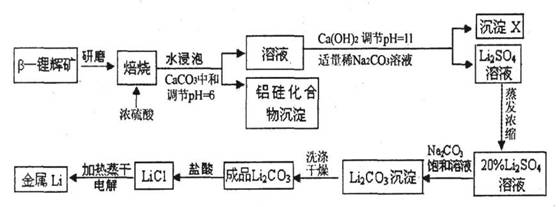
(1)用氧化物形式表示LiAlSi2O6的组成:___________________。
(2)沉淀X的主要成分是(写化学式)________________________。
(3)流程中两次使用了Na2CO3溶液,试说明前后浓度不同的原因:
____________________________________________________________________。
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:_______________________________________。
(5)将盐酸与Li2C03完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
为了探究铁与氯气在一定条件下反应后的固体中铁元素的价态,化学兴趣小组的甲、乙、丙三同学分别进行了如下实验。
(1)甲取少许反应后的固体,加入适量稀硝酸,在所得溶液中滴加KSCN溶液出现血红色,则此时溶液显血红色的离子方程式为_________________________________________________。该同学由此得出铁与氯气的反应产物中含有+3价铁的结论。请指出该结论是否合理并说明理由_________________________________________________________。
(2)乙取少许反应后的固体,加入盐酸,溶解、过滤,向滤液中滴加KSCN溶液,溶液呈无色。乙由此得出铁与氯气的反应产物中含有+2价铁的结论。请指出该结论是否合理并说明理由
_____________________________________________________________________________。
(3)丙取11.2g铁粉与氯气反应,将反应后所得固体研碎分成两等份,其中一份用磁铁吸引,吸出的固体质量为1.4g;另一份用水完全溶解后加入足量的硝酸银溶液,所得白色沉淀经洗涤干燥后称重为32.29g。根据以上数据确定反应产物中铁元素的价态是____________(写出计算和推理过程)。
查看答案和解析>>
科目: 来源: 题型:
某炼铁废渣中含有大量的CuS及少量铁的氧化物,工业上以该废渣和NaCl为原料生产CuCl2·2H2O晶体,其工艺流程中主要涉及焙烧、尾气处理、酸浸、调控溶液pH、过滤、蒸发结晶等。焙烧过程中发生的主要反应为:
CuS+2NaCl+2O2 = CuCl2+Na2SO4
请回答下列问题:
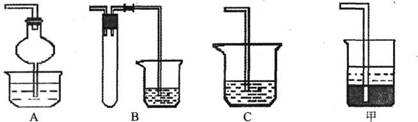
(1)焙烧时还有废气产生,其中一种是主要的大气污染物。若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是________(填字母);若选用甲装置,则烧杯中的下层液体可以是_______。
(2)调控溶液pH时采用pH试纸来测定溶液的pH,则正确的操作方法是___________________ 。
(3)若最后所得的滤液中的阴离子只有S042-和Cl-,则检验滤液中这两种离子的实验操作为______ _ 。
查看答案和解析>>
科目: 来源: 题型:
T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g) Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是

A.该反应的正反应是吸热反应
B.T0℃,从反应开始到平衡时:v(X)=0.083mol·L-1·min-1
C.图a中反应达到平衡时,Y的转化率为37.5%
D.T1℃时,若该反应的平衡常数K=50,则T1<T0
查看答案和解析>>
科目: 来源: 题型:
右图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做
 “Janusene”,有关Janusene的说法正确的是
“Janusene”,有关Janusene的说法正确的是
A.Janusene的分子式为C30H20
B,Janusene分子中的手性碳原子有6个
C.Janusene的一氯代物有4种
D.Janusene既可发生氧化反应,又可发生还原反应
查看答案和解析>>
科目: 来源: 题型:
下列溶液中有关粒子的物质的量浓度关系正确的是
A.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
B.25℃时,pH=12的NaOH溶液与pH=12的氨水中:c(Na+)=c(NH4+)
C.pH=4的0.1 mol·L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.等物质的量的Na2CO3、NaHCO3的混合溶液中:
c(CO32-)+2c(OH-)=c(HCO3-)+c(H2CO3)+2c(H+)
查看答案和解析>>
科目: 来源: 题型:
![]() 下列反应的离子方程式正确的是
下列反应的离子方程式正确的是
A.用石墨作电极电解CuCl2溶液:2C1-+2H20 Cl2↑+H2↑+20H-
B.向NaAl02溶液中通入过量CO2:Al02-+CO2+2H2O=Al(OH)3↓+HCO3-
C.硫酸亚铁溶液与稀硫酸、双氧水混合:Fe2++2H2O2+4H+=Fe3++4H20
D.等体积等物质的量浓度的NaHC03溶液与Ba(OH)2溶液混合:
HC03-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com