
科目: 来源: 题型:阅读理解
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
⑴反应开始到平衡,H2的平均反应速率v(H2)=_____mol/(L·min)。H2的转化率为 。
⑵能判断该反应是否达到化学平衡状态的依据是 。
(a)容器中压强不变 (b)混合气体中 C(CO2)=C(H2O)
(c)V正(H2)=3 V逆(H2O) (d)混合气体的密度
(e)混合气体的平均分子量
⑶下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
E.使用催化剂 F.缩小容器体积
⑷反应进行到3分钟时,同种物质的v正 与v逆的关系: v正 v逆 (填>,=,<)
⑸上述反应平衡常数的表达式为 ,经计算该温度下此反应平衡常数的数值为 。
⑹如果上述反应在相同温度和容器中进行,改变起始时加入物质的量,欲使反应达到平衡时CH3OH(g)的体积分数不变,则下列投料理论上合理的是
A.2mol CO2和6mol H2 B.1mol CO2和4mol H2
C.1mol CO2和3mol H2,1molNe
D.0.5mol CO2. 1.5mol H2 0.5mol CH3OH(g) 0.5mol H2O(g)
查看答案和解析>>
科目: 来源: 题型:
某研究小组将体积为V1、浓度为1.0mol·L-1的HCl溶液和体积为V2、浓度未知的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。请回答下列问题:
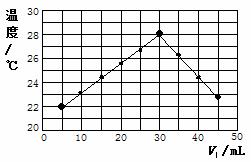
⑴研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22℃,判断的依据是 。
⑵由题干及图形可知,V1:V2= 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol·L-1。
⑶若通过实验测定及有关计算知:当HCl溶液与NaOH溶液完全反应时共放出Q kJ的热量,请写出此反应的热化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
II下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

⑴②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________________________。②、③、④的氢化物的热稳定性由大到小顺序为 。
⑵用电子式表示元素①与③的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。该化合物所含的化学键类型为
⑶②和④按质量比3:8形成的化合物A的电子式为 ,将过量A通入由④和⑥形成的阴离子的盐溶液的离子方程式为 。
⑷由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
查看答案和解析>>
科目: 来源: 题型:
已知反应:X(g)+2Y(g) ![]() 2Z(g)。现将X和Y气体按体积比1∶2混合于一密闭容器中,并加压到3×107Pa时达到平衡状态。此时反应物、生成物的物质的量之比为6∶1,则此时反应于图中的温度应为( )
2Z(g)。现将X和Y气体按体积比1∶2混合于一密闭容器中,并加压到3×107Pa时达到平衡状态。此时反应物、生成物的物质的量之比为6∶1,则此时反应于图中的温度应为( )
A.100℃ B.200℃
C.300℃ D.400℃

查看答案和解析>>
科目: 来源: 题型:
某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是( )
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是( )
A.刚充入时反应速率υ正减少,υ逆增大 B.平衡不发生移动
C.平衡向逆反应方向移动 D.物质C的质量分数增大
查看答案和解析>>
科目: 来源: 题型:
可逆反应 A(气) + nB(气) ![]() 2C(气) (正反应吸热)在一定温度下,反应物 B 的转化率与压强有如图所示的关系,那么 n 值一定是( )
2C(气) (正反应吸热)在一定温度下,反应物 B 的转化率与压强有如图所示的关系,那么 n 值一定是( )
A.>1 B.≥ 1 C.1 D. 2

查看答案和解析>>
科目: 来源: 题型:
几种短周期元素的原子半径及主要化合价见下表:
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
根据表中信息,判断以下说法正确的是( )
A.离子的还原性:T2->Z2- B.离子半径:T2->X2+
C.元素最高价氧化物对应的水化物的碱性:Y > R >X D.形成氢化物的沸点: Z>T
查看答案和解析>>
科目: 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:
N2(g)+3H2(g) ![]() 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值小

查看答案和解析>>
科目: 来源: 题型:
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
查看答案和解析>>
科目: 来源: 题型:
在一体积不可变容器中发生如下反应:2NO2 ![]() 2NO + O2 DH>0 达到平衡后,升温,混合气体的( )不变
2NO + O2 DH>0 达到平衡后,升温,混合气体的( )不变
A.颜色 B.密度 C.压强 D.总物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com