
科目: 来源: 题型:
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li![]() 的高分子材料。这种锂离子电池的电池反应为:
的高分子材料。这种锂离子电池的电池反应为:![]()
Li+2Li![]() 下列说法不正确的是
下列说法不正确的是
![]() A.放电时,负极的电极反应式:Li-e
A.放电时,负极的电极反应式:Li-e![]() =Li
=Li![]()
B.充电时,Li![]() 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
![]() C.该电池不能用水溶液作为电解质
C.该电池不能用水溶液作为电解质
D.放电过程中Li![]() 向负极移动
向负极移动
![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应![]() 不能自发进行,则该反应的
不能自发进行,则该反应的![]()
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中![]() 、
、![]() 、
、![]() 的氧化性依次减弱
的氧化性依次减弱
查看答案和解析>>
科目: 来源: 题型:
已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
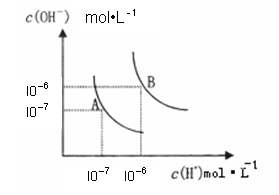 (1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度。100°C时1 mol·L﹣1 的NaOH溶液中,由水电离出的c(H+)= mol·L﹣1,
(1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度。100°C时1 mol·L﹣1 的NaOH溶液中,由水电离出的c(H+)= mol·L﹣1,
KW(25°C) KW(100°C)(填“>”、“<”或“=”之一)。25°C时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是 (填“促进”“抑制”或“不影响”之一)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小
的顺序为 。
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则
c(Na+) c(CH3COO-)(填“>”、“<”或![]() “=”之一)。
“=”之一)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:
。
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,容积为0.5L的密闭容器中,将一定量的二氧化氮和二氧化硫气体混合会发生如下反应:
NO2(g)+SO2(g)![]() NO(g)+SO3(g)
NO(g)+SO3(g)
(1)该反应的平衡常数(K)表达式为_________________________。
(2)该可逆反应达到平衡的标志是 ![]() (填下列序号字母 )。
(填下列序号字母 )。
a. NO2、SO2、NO和SO3四种气体的物质的量浓度之比为1∶1∶1∶1
b. 密闭容器的压强不再发生变化
c. K值不再发生变化
d. 生成n molSO2的同时,有n molSO3生成
(3)在上述平衡体系中通入少量O2,平衡 移动(填“向右”、“向左”或“不”之一);NO的浓度将 (填“增大”、“减小”或“不变”之一),c(NO)与c(NO2)之和 (填“增大”、“减小”或“不变”之一)。
(4)若10 min后容器内SO3气体质量为4g。则在10 min内用NO2浓度的变化表示反应的平均反应速率为________________ mol•(L•min)﹣1。
查看答案和解析>>
科目: 来源: 题型:
FeSO4•7H2O广泛用于医药和工业领域,以下是FeSO4•7H2O的实验室制备流程图。根据题意完成下列填空:
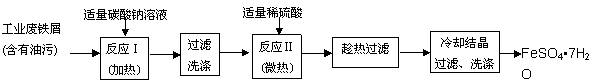

操作① 操作② ![]() 操作③ 操作④ 操作⑤
操作③ 操作④ 操作⑤
(1)操作①中碳酸钠溶液能除去油污,原因是 (用离子方程式表示)。
(2)下列物质分离方法的原理与过滤相同的是 (填序号字母)。
a.蒸馏 b.分液
c.渗析 d.重结晶
(3)FeSO4•7H2O是某些补血剂的主要成分,实验室中为测定某补血剂中铁元素的含量,进行了以下实验:①配制100mL1.00×10-2mol·L-1的KMnO4溶液,所用的仪器有天平、烧杯、胶头滴管及 。配制过程中下列说法中,正确的是 (填序号字母)。
a. KMnO4溶于水不放热,可以直接在容量瓶中溶解
b.容量瓶洗涤后不需干燥即可直接用于实验
c.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
d.如果定容时加水超过刻度线必须重新配制
②取2.0g克该补血剂配成溶液,进行预处理,使其中的铁元素全都是Fe2+,再用配制好的标准KMnO4溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+ = 5Fe3++Mn2++4H2O。进行滴定时,标准KMnO4溶液应该盛放在 (填“酸式”或“碱式”之一)滴定管中,原因是
。
③滴定结束时,消耗浓度为1.00×10-2mol·L-1的标准KMnO4溶液26.00mL,则该补血剂中铁元素的含量为 %。
查看答案和解析>>
科目: 来源: 题型:
(1)实验是化学研究的基础,下列有关说法中,正确的是_______(填序号字母) 。
a.可在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
b.用pH试纸测定溶液的pH时,不需用蒸馏水润湿试纸
c.实验室中不慎将酒精撒在台面上起火,可用湿抹布覆盖灭火
d.实验室取用少量白磷时,可将白磷取出,在空气中用小刀切割
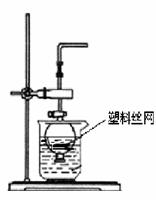
(2)用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如右图所示。能用此装置制备的气体有 ![]()
![]() (填序号字母)。
(填序号字母)。
a. 用块状大理石与盐酸反应制取CO2
b. 用锌粒与稀硫酸反应制取H2
c. 用过氧化钠与水反应制取O2
d. 用二氧化锰与浓盐酸反应制取Cl2
查看答案和解析>>
科目: 来源: 题型:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸。请回答:
(1)氨气催化氧化的化学方程式为 。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为: 。
(3)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2 点燃 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是_________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)制得的硝酸可以跟金属铜反应生成硝酸铜溶液,用石墨电极电解该硝酸铜溶液,则电解过程中阳极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
元素A和B对应的单质都是化学性质比较活泼的物质。
(1)A的单质室温下是黄绿色气体,则元素A在元素周期表中的位置是 周期 族,实验室制取A单![]() 质的离子方程式是 。;
质的离子方程式是 。;
(2)B是第三周期中除稀有气体元素外,原子半径最大的元素,且B的一种氧化物颜色为淡黄色,则该氧化物中含有的化学键类型为 。
查看答案和解析>>
科目: 来源: 题型:
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O32-和Cl2反应的产物之一为SO42-。下列说法中,不正确的是
A.该反应中氧化剂是Cl2
B.根据该反应可判断还原性:S2O32- > Cl-
C.上述反应中,每生成l mol SO42-,可脱去2mol Cl2
D.SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com