
科目: 来源: 题型:
在373K时,把0.125molN2O4气体通入体积为500mL的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2含量为0.01mol,进行到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍,则求:
(1)开始2s内,以N2O4表示的反应速率。
(2)N2O4的平衡转化率。
(3)达平衡时,体系的压强是开始时的多少倍?
查看答案和解析>>
科目: 来源: 题型:
反应aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a∶b∶c为________。
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________。
(3)由第一次平衡到第二次平衡,平衡移动的方向是____________,采取的措施是__________________________。
(4)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低: T2________T3(填“>”、“=”、“<”),判断的理由是__________________________。
(5)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。

查看答案和解析>>
科目: 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:
C(s)+H2O(g) ![]() CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t/(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.7 | 0.8 | 1.0 | 1.6 | 2.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________,该反应为________反应(填“吸热”或“放热”)。
(2)能作为判断反应达到化学平衡状态的依据是________。
A.容器中压强不变
B.混合气体的平均相对分子质量不再变化
C.v正(H2)=v逆(H2O)
D.c(H2)=c(CO)
(3)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积,平衡________移动(填“正向”、“逆向”或“不”)。H2O(g)的浓度_______,CO(g)的浓度_______ (填“变大”、“不变”或“变小”)
查看答案和解析>>
科目: 来源: 题型:
下图中A、D均为碳棒,B为铝棒,C为铁棒,硫酸钠溶液在实验前采取了煮沸处理。B在实验时才插入溶液中。

(1) 从装置的特点判断,甲、乙装置中_______是原电池,正极的电极反应式为_______________________。
(2) 实验开始后,乙装置中有关电极反应式为:C_______________________,D_______________________ 。
一段时间后溶液中的现象是,_______________________,若用某电解质溶液代替硫酸钠溶液也能出现相同的现象,则此溶液可以是( )
A.NaOH溶液 B. AgNO3溶液 C. NaCl溶液 D.CuSO4溶液
(3) 实验前煮沸硫酸钠溶液的目的是______________________ 。
(4) 在实验(2)的基础上,改变两电极的连接方式,A接D、B接C,此时D电极上的电极反应式为______________________ 。乙装置里除两电极有明显现象外,还可以看到的现象是________________________________________,产生该现象的化学方程式是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它
们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼
肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是_______________________。_
(4)已知N2(g)+2O2(g)=2 NO2(g);△H=+67.7 kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的 热化学方程式________________________________________。
查看答案和解析>>
科目: 来源: 题型:
往一个体积不变的密闭容器中充入H2和I2发生反应:H2(g)+I2(g)![]() 2HI(g)
2HI(g)
△H< O,当达到平衡后,t0时改变某一条件(混合气体物质的量不变),造成容器内压强增大,下列说法正确的是( )
A.容器内气体颜色不变,平均相对分子质量变小
B.平衡移动,混合气体密度不变
C.H2的转化率增大,HI平衡浓度变小
D.改变条件前后,速率图象如右图

查看答案和解析>>
科目: 来源: 题型:
可逆反应nA(?)+2 B(g)![]() 2C(g)+D(g),其中n为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
2C(g)+D(g),其中n为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
A.达到平衡后,加入催化剂则C%增大
B.n可以为任意的正整数
C.达到平衡后,若升高温度,平衡向右移动
D.达平衡后,增加A的量,有利于平衡向右移动

查看答案和解析>>
科目: 来源: 题型:
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的正确结论是( )
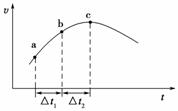
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目: 来源: 题型:
对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是( )
A.化学反应速率变化时,化学平衡一定发生移动
B.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
C.正反应进行的程度大,正反应速率一定大
D.化学平衡发生移动时,化学反应速率一定变化
查看答案和解析>>
科目: 来源: 题型:
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L
(标准状况)氧气,从而可知M的相对原子质量是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com