
科目: 来源: 题型:
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是
A.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱
B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.第IA族的金属单质与水反应一定比第IIA族的金属单质剧烈
D.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
具有相同电子层结构的不同离子,其半径随核电荷数增大而减小
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.稀硫酸中加入铁粉: 2Fe + 6 H+ = 2 Fe 3+ + 3H2 ↑
C.硫酸铝溶液中加入过量氨水: Al 3++ 3OH- =Al(OH)3 ↓
D.NaHCO3溶液中加入少量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是
A.常温下,将铝片放入浓硝酸中,无明显现象,说明铝不与冷的浓硝酸反应
B.元素由化合态变成游离态时,可能被氧化,也可能被还原
C.自然界中没有游离态的硅,纯净的硅晶体可用于制作计算机芯片
D.从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤,氧化剂一般选择氯气
查看答案和解析>>
科目: 来源: 题型:
下列有关物质的性质与应用不相对应的是
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.自行车钢架生锈主要是化学腐蚀所致
C.食醋可去除水垢,NH4Cl溶液可去除铁锈
D.新型复合材料使手机、电脑等电子产品更轻巧,实用和新潮
查看答案和解析>>
科目: 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2L水中含有分子的数目为0.5NA
B.100mL0.2mol·L-1的FeCl3溶液中,含Fe3+数为0.02NAC.1mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA
D.在密闭容器中加入0.5molN2和l.5mol H2,充分反应后可得到NH3分子数为NA
查看答案和解析>>
科目: 来源: 题型:
氧元素是地壳中含量最多的元素。下列说法中,正确的是
A.16O2与18O3互为同位素
B.氧与钠形成的稳定化合物是离子化合物
C.O2变成O3以及16O变成18O的变化均属于化学变化
D.氧元素与第三周期金属元素的形成的氧化物都属于碱性氧化物
查看答案和解析>>
科目: 来源: 题型:
分类法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是( )
①根据氧化物的元素组成将氧化物分成酸性氧化物、碱性氧化物
②根据分散系分散质微粒大小将分散系分为溶液、胶体和浊液
③根据水溶液导电能力的大小将电解质分为强电解质和弱电解质
④根据组成元素是否含有碳元素将化合物分成无机化合物和有机化合物
⑤根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
⑥根据反应的热效应将化学反应分为放热反应和吸热反应
A. ①② B. ①③④ C. ②③⑤ D. ②⑤⑥
查看答案和解析>>
科目: 来源: 题型:
化学与生产、生活密切相关。下列说法中,不正确的是
A.“血液透析”利用了胶体的性质
B.服用铬含量超标的药用胶囊会对人体健康造成危害
C.人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因
D.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染
查看答案和解析>>
科目: 来源: 题型:阅读理解
将MgCl2溶液加入NaOH和Na2CO3的混合溶液中,溶液中的离子反应如下:先发生Mg2++2OH-===Mg(OH)2↓,后发生Mg2++CO![]() ===MgCO3↓;经查溶解度表得知, Mg(OH)2的溶解度小于MgCO3的溶解度。在溶解度表中有这样一组数据,表示四种物质在水中、液氨中的溶解度(g溶质/100 g溶剂),如下表:
===MgCO3↓;经查溶解度表得知, Mg(OH)2的溶解度小于MgCO3的溶解度。在溶解度表中有这样一组数据,表示四种物质在水中、液氨中的溶解度(g溶质/100 g溶剂),如下表:
| 溶质 溶剂 | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水 | 170 | 9.3 | 1.5×10-4 | 33.3 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
(1)分别是1.0 mol· L-1的Ag+、Ba2+、NO![]() 和Cl-在水中发生反应的离子方程式是______________________________________________________________。
和Cl-在水中发生反应的离子方程式是______________________________________________________________。
(2)分别是0.50 mol· L-1的以上四种离子在液氨中发生反应的离子方程式是__________________________________________________。
II(6分)、某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有
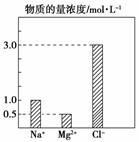 Fe3+、Ba2+、K+、OH-、NO3-、
Fe3+、Ba2+、K+、OH-、NO3-、![]() 、
、![]() 。为了进一步确认,对该溶液进行实验检测:
。为了进一步确认,对该溶液进行实验检测:
①仔细观察,该溶液呈无色、透明、均一状态。
②向100mL溶液中滴入稀硫酸,有23.3g白色沉淀产生,再加稀硝酸,白色沉淀不消失。回答下列问题:由此可知,除了含有Na+、Mg2+、Cl-外,该溶液中肯定还含有的离子及其物质的量浓度为___________,肯定没有的离子是___________,可能含有的离子是___________。
III(6分).试样X由氧化亚铁和氧化铜组成。取质量相等的两份试样进行下图所示实验:
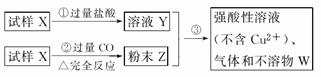
(1)写出步骤③发生的全部反应的离子方程式。
(2)若Y和Z充分反应,生成的不溶物的质量是m,则每份试样X中氧化铜的质量为 (用m表示)。
查看答案和解析>>
科目: 来源: 题型:
氧化还原反应在生产和生活中使用非常广泛。
I(4分)、一个体重50 kg的健康人含铁2 g,这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是__________。
A. Fe B. Fe2+ C. Fe3+
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。下列也能实现这种转化的物质是________。
A. Cl2 B. O2 C. FeCl3 D.浓硫酸
(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________性。
II(8分)、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As——砷)
![]() (1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
(1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
![]() (2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
![]() (3)根据上述反应可推知 。
(3)根据上述反应可推知 。
![]() a.氧化性:
a.氧化性:![]() b.氧化性:
b.氧化性:![]()
![]() c.还原性:
c.还原性:![]() d.还原性:
d.还原性:![]()
![]() (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方![]() 向和数目:
向和数目:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com