
科目: 来源: 题型:
下列离子方程式表示正确的是( )
A.AgNO3溶液中加入Cu:Cu + Ag+ = Cu2+ + Ag
B.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42—+Ba2++OH—==BaSO4↓+H2O
C.甲酸溶液滴到大理石台板上有气泡产生:2H+ + CaCO3 = CO2↑+ Ca2+ + H2O
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:
HCO3- + Ba2+ + OH- = BaCO3↓+ H2O
查看答案和解析>>
科目: 来源: 题型:
若NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.16g CH4与18 g NH4+ 所含质子数相等
B.1mol 苯分子中含有碳碳双键数为3NA
C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22. 4L
D.7.8 g Na2O2中含有的离子总数目为0.3NA
查看答案和解析>>
科目: 来源: 题型:
某同学在实验报告中记录下列数据,其中正确的( )
A.用 25mL 量筒量取 18.63mL 盐酸 B.用托盘天平称取 12.15克食盐
C.用标准的 NaOH 溶液滴定未知浓度的盐酸,用去 NaOH 溶液32.30mL
D.用 pH 试纸测得某溶液 pH 为 5.0
查看答案和解析>>
科目: 来源: 题型:
下列图示实验合理的是( )
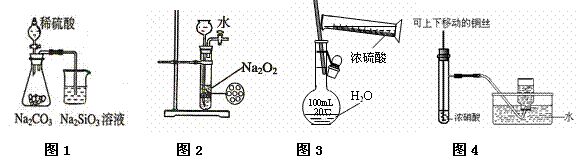 |
A.图1为证明非金属性强弱:![]() B.图2为制备少量氧气
B.图2为制备少量氧气
C.图3为配制一定物质的量浓度的硫酸溶液 D.图4为制备并收集少量NO2气体
查看答案和解析>>
科目: 来源: 题型:
分类法在化学的发展中起到非常重要的作用,下列分类标准合理的是( )
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物和两性氧化物
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔效应将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
⑤根据水溶液能否导电将化合物分为电解质和非电解质
A.②④⑤ B.②④ C.①③⑤ D.①②④⑤
查看答案和解析>>
科目: 来源: 题型:
化学是一门实用性很强的科学,与社会、环境等密切相关。下列说法错误的是( )
A.“低碳经济”是指减少对化石燃料的依赖,达到低污染、低排放的模式
B.“低碳生活”倡导生活中耗用能量尽量减少,从而减少CO2排放
C.所有垃圾都可以采用露天焚烧或深埋的方法处理
D.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
查看答案和解析>>
科目: 来源: 题型:
运用化学知识解决生产、生活中的有关问题备受关注。请回答下列问题:
(1)已知水存在如下平衡:H2O![]() H++OH- △H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是 。
H++OH- △H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是 。
A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯。当400mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
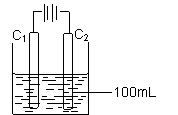 (4)实验室中采用惰性电极模拟工业上电解饱和食盐水的过程:
(4)实验室中采用惰性电极模拟工业上电解饱和食盐水的过程:
①写出C1电极上发生反应的电极反应式 。
②当C2电极上产生112mL(标准状况)气体时(假设气体完全
逸出,溶液体积不变),烧杯中溶液的pH= 。(Kw=10-14)
查看答案和解析>>
科目: 来源: 题型:
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义。
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜。该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g) △H=-768.2KJ·mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0KJ·mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的 △H= 。
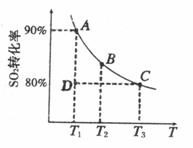 (2)硫酸生产中涉及反应:2SO
(2)硫酸生产中涉及反应:2SO![]() (g)+O
(g)+O![]() (g)
(g)![]() 2SO
2SO![]() (g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
② 某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol·L-1,则0~10min内的平均反应速率v(SO2)= ,该温度下反应的平衡常数K= 。
③ 下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO![]() 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
④ 以下操作将引起平衡向正反应方向移动并能提高SO![]() 转化率的是
转化率的是
A.向容器中通入少量O![]() B.向容器中通入少量SO
B.向容器中通入少量SO![]()
C.使用催化剂 D.升高温度 E.恒容通入少量氦气
⑤ 气体SO2是大气污染物,可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨
查看答案和解析>>
科目: 来源: 题型:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下,请回答下列问题:
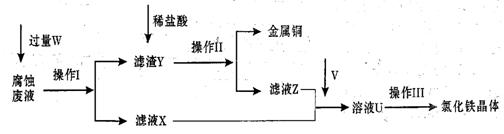
(1)请写出FeCl3溶液与铜反应的离子方程式: ;操作Ⅰ加入的试剂W是 。
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol• L-1 的浓盐酸配制250mL 1mol• L-1 的稀盐酸,并进行有关实验。
①需要量取浓盐酸 mL。
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有 、 。
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视 ,实验时未用标准液润洗滴定管,测得锥形瓶中待测液的浓度 实际浓度。(填“>”、“<”或“=”)。
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式: ,该反应中 是氧化剂。
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是 。
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质 。请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足 (简要说明实验步骤、现象和结论)。
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水。
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀。该过程中调节溶液的pH为5,则金属离子浓度为 。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com