
科目: 来源: 题型:
如图所示为电解质溶液的PH随外界条件T变化的图像,
下列的叙述不正确的是( )
A.若T代表温度,Na![]() CO
CO![]() 溶液符合曲线a的变化
溶液符合曲线a的变化
B.若T代表温度,醋酸稀溶液符合曲线d的变化
C.若T代表温度,明矾溶液符合曲线c的变化
D.若T代表加入水的量,氨水符合曲线b的变化

查看答案和解析>>
科目: 来源: 题型:
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:c<a<b
B. a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D. a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗
氢氧化钠溶液体积:c<a<b
加水的体积
查看答案和解析>>
科目: 来源: 题型:
下列各组数据中其比值为2:1 的是( )
A.Na2CO3溶液中C(Na+)与C(CO32-)之比
B.相同温度下,0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中C(H+)之比
C.pH=7的氨水与(NH4)2SO4的混合溶液中C(NH4+)与C(SO42-)之比
D.2SO2+O2 ![]() 2SO3该反应无论是否达到平衡,SO2的消耗速率与O2生成速率之比
2SO3该反应无论是否达到平衡,SO2的消耗速率与O2生成速率之比
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.升高温度会加快化学反应速率,其原因是活化能降低,增加了活化分子的百分数
B.对于反应2NO2 (g) ![]() N2O4(g);ΔH<0,升高温度,正逆反应的速率都增大,但正反应速率的增加幅度小于逆反应速率的增加幅度
N2O4(g);ΔH<0,升高温度,正逆反应的速率都增大,但正反应速率的增加幅度小于逆反应速率的增加幅度
C.中和等量的NaOH溶液消耗pH均为3的盐酸、醋酸溶液体积相同
D.已知2C(s)+2O2(g)=2CO2(g);ΔH1 2C(s)+O2(g)=2CO (g);ΔH2 则ΔH1>ΔH2
查看答案和解析>>
科目: 来源: 题型:
下列实验操作中一定会造成误差的是( )
A.将pH试纸用蒸馏水润湿后测某溶液的pH
B.在中和热测定实验中用Ba(OH)2溶液代替NaOH溶液,硫酸代替盐酸
C. 酸碱中和滴定实验中当指示剂颜色变化后立即就读数
D.使用天平称量时将药品与砝码的位置放反了
查看答案和解析>>
科目: 来源: 题型:
在给定的四种溶液中加入以下各种离子,各离子能在溶液中大量共存的是( )
A.滴加甲基橙试液显黄色的溶液 K+、Fe3+、C2O42-、MnO4¯
B.pH值为1的溶液 NH4+、Mg2+、I¯、SO42-
C.含有大量S2-的溶液 Cu2+、Na+、SO42-、Cl¯
D.水电离出来的C(H+)=10-13mol/L的溶液 Ba2+、K+、HCO3¯、Br¯
查看答案和解析>>
科目: 来源: 题型:
下列反应中,在高温下不能自发进行的是( )
A、(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) B、2N2O5(g)=4NO2(g)+O2(g)
C、MgCO3(s)=MgO(s)+CO2(g) D、CO(g)=C(s)+1/2O2(g)
查看答案和解析>>
科目: 来源: 题型:
下列性质中,不能说明乙酸是弱电解质的是( )
A.乙酸钠溶液显碱性
B.常温时,0.1mol/L乙酸溶液的pH约为3
C.10mL1mol/L乙酸溶液与10mL1mol/L的NaOH溶液恰好完全反应
D.在相同温度下,同物质的量浓度的乙酸溶液的导电性比盐酸弱
查看答案和解析>>
科目: 来源: 题型:阅读理解
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g) ![]() CH3OH(g) Δ H
CH3OH(g) Δ H
(1)判断反应达到平衡状态的依据是 (填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变 c. 混合气体的相对平均分子质量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH 0 (填“>”、“=”或“<”)。
②要提高CO的转化率,可以采取的措施是_________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 。以CH3OH表示该过程的反应速率
v(CH3OH)= mol /(L · min)。
(3)图一表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。


(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出QKJ的热量。写出该反应的热化学方程式 。
图二是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式 。
查看答案和解析>>
科目: 来源: 题型:
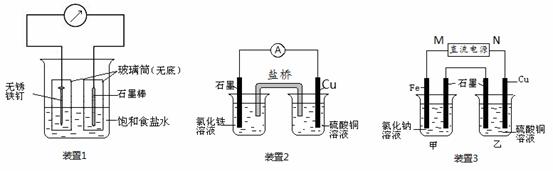
如图所示3套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6] 溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被 (填“ 氧化”或“还原”); 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com