
科目: 来源: 题型:
(1)高铁酸钾是20世纪70年代以来开发的一种继臭氧、过氧化氢、二氧化氯之后一种新型水处理剂,它能快速杀灭水中的细菌和病毒,且不会生成三氯甲烷、氯代酚等次级衍生物。高铁酸根(FeO42-)在溶液中呈紫红色,溶液的pH对高铁酸根稳定性的影响很大,当pH值为10-11时非常稳定,而当pH<7.5时,稳定性明显下降,分解放出氧气,并析出具有高度吸附活性的无机絮凝剂Fe(OH)3。电解法制备高铁酸钾原理如右图所示。
电解质溶液应选用______________
A、NaOH溶液 B、NaCl溶液 C、稀硫酸
(2) 电解过程中可能观察到的实验现象有 。
(3) 生成 高铁酸根(FeO42-)的电极反应是 。
高铁酸根(FeO42-)的电极反应是 。
查看答案和解析>>
科目: 来源: 题型:
CH3CHO是有毒物质,易溶于水,含高浓度CH3CHO的废水可以用隔膜电解法处理,总反应为:
2CH3CHO(l) + H2O(l) === CH3CH2OH(l) + CH3COOH(l) ;△H
(1)依次写出该反应中三个有机物的官能团名称_____、_______、_______(每空1分)
(2)已知CH3CH2OH、CH3CHO、CH3COOH的燃烧热分别为1366.8 kJ/mol、1166.4kJ/mol、874.8kJ/mol,则△H=_____________
(3)现在实验室中模拟乙醛废水的处理过程,模拟废水为一定浓度的乙醛—Na2SO4溶液,其装置示意图如下图所示。


①b是直流电源的______极。
②Na2SO4的作用是_______________________________________。
③阳极除去乙醛的电极反应为
(4)在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛的含量为3000 mg/L的废水,可得到乙醇 kg(计算结果保留小数点后1位)。
查看答案和解析>>
科目: 来源: 题型:阅读理解
我校化学兴趣小组拟通过中和滴定实验验证某品牌陈醋的酸度。
(1)查阅资料:
①食醋组成极为复杂,除水以外的主要成分是醋酸CH3COOH,此外还有其他各种有机物和一些无机物等微量成分,醋酸的含量远远多于其他成分的含量。另外其中含一些色素成分,使食醋呈棕色(白醋除外)。
②0.1mol/L醋酸与氢氧化钠反应的滴定终点的pH约为________________
A 5.6 B 7.0 C 8.8 D 13.0
③包装显示该陈醋的酸度约是3.6g/100mL
(2)由以上资料,同学们认为:
①测量时可以忽略老陈醋其他成分特别是有机酸所带来的影响。
②根据陈醋的特点,只能选用______________来指示滴定终点。
A 甲基橙 B 酚酞 C 石蕊 D pH计
③为使滴定时溶液中的醋酸浓度接近0.1mol/L,应将10ml样品醋稀释至____________。
A 36 ml B 60 ml C 360 ml D 600 ml
(3)配制标准氢氧化钠溶液
由于NaOH在称量过程中极易吸水,配好的溶液浓度往往比预期偏小。故实验小组先用0.1010 mol/L 的KHP标准溶液准确测定NaOH溶液的浓度(KHP与NaOH按物质的量比1:1完全反应)。向锥形瓶中盛入20.00ml NaOH溶液时,应用______________量取。
A. 20ml 的量筒 B. 100ml 的容量瓶 C.碱式滴定管 D. 酸式滴定管
| V(NaOH) | V(KHP)平均 |
| 20.00 mL | 18.00 mL |
(4)用标准氢氧化钠溶液测定醋酸的浓度,并换算为酸度。
| V(稀释后的醋) | V(NaOH)平均 |
| 18.00 mL | 20.00 mL |
计算得出该陈醋样品的酸度为______________g/100mL。(计算结果保留4为有效数字)
查看答案和解析>>
科目: 来源: 题型:
镁燃料电池具有高比能量、安全和成本低等特点,在军事和民用方面有良好的应用前景。镁燃料电池的氧化剂可以利用空气或者海水中的氧,还有过氧化氢和次氯酸盐等。
(1) 中性条件下镁-空气燃料电池的正极反应为__________________。
(2) 下图为镁-次氯酸盐燃料电池示意图,电极为镁合金和铂合金,图中A极的电极反应方程式为_________________,B极的电极反应方程式为__________________。


(3) 然而,镁电池总体上存在着三大缺陷:容量损失大,负极利用率低,电压损耗大。其中,容量损失大和负极利用率低主要是由于镁的自腐蚀引起的,且温度越高,自腐蚀越快,试写出在中性水溶液中,镁电极自腐蚀反应的化学方程式___________________。
查看答案和解析>>
科目: 来源: 题型:
CuI是一种不溶于水的白色固体,它可以由反应:
2Cu2++4I—==2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色。对阳极区溶液呈蓝色的正确解释是
A. 2I—-2e-==I2 碘遇淀粉变蓝
B. Cu-2e-==Cu2+ Cu2+ 显蓝色
C. 2Cu+4I--4e-==2CuI↓+I2 碘遇淀粉变蓝
D. 4OH—–4e-==2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝
查看答案和解析>>
科目: 来源: 题型:
模拟铁的电化学防护的实验装置如右图所示,下列说法不正确的是
A. 若X为碳棒,开关K须置于A处才可以减缓铁的腐蚀
B. 若X为锌棒,开关K须置于B处才可以减缓铁的腐蚀
C. 若X为铜棒,开关K须置于A处才可以减缓铁的腐蚀
D. 若X为碳棒,开关K置于A、B之间(如图)时,向溶液中滴加K3[Fe(CN)6]溶液,出现蓝色沉淀

查看答案和解析>>
科目: 来源: 题型:
右图是铅蓄电池充放电时的工作示意图,下列说法正确的是
A.K与N连接时,能量由电能转化为化学能
B.K与N连接时,两电极质量都增加
C.K与M连接时,a为电源正极
D.K与M连接时,电解质溶液pH变大
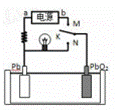
查看答案和解析>>
科目: 来源: 题型:
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。下列叙述正确的是
A. 阳极产生的气体为氟气
B. 阳极区放出的气体只是纯氧气
C. TiO2在阴极表面放电
D. 制备金属钛前后,CaO的总量不变

查看答案和解析>>
科目: 来源: 题型:
将反应5IO3-+I-+6H+![]() 3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是
3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是

A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应
B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝。
C.电流计读数为零时,反应达到化学平衡状态
D.两次电流计指针偏转方向相反
查看答案和解析>>
科目: 来源: 题型:
下列溶液中有关物质的浓度关系正确的是
A.pH相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:
c(NH4HSO4) > c(NH4Cl)>c[(NH4)2SO4]
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.1.0 mol/L Na2CO3溶液中:
c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.某二元弱酸的酸式盐NaHA溶液中:
c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com