
科目: 来源: 题型:
一定温度下,将1mol N2O4充入一恒压密闭容器中,发生反应N2O4(g)![]() 2NO 2(g), 下列示意图正确且能说明反应达到平衡状态的是
2NO 2(g), 下列示意图正确且能说明反应达到平衡状态的是
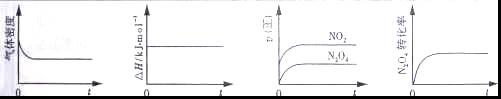
① ② ③ ④
A.仅①和④ B.仅②和③ C.仅①②③ D.仅②③④
查看答案和解析>>
科目: 来源: 题型:
下列有关叙述错误的是
A.若根据反应“H2+Cl2=2HCl”设计成燃料电池,既可发电同时还可用于制备盐酸
B.冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小
C.常温下,吸热反应也可能自发进行
D.催化剂能改变可逆反应达到平衡的时间
查看答案和解析>>
科目: 来源: 题型:阅读理解
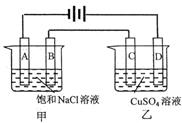 电解原理在化学工业上有着广泛的应用,按下图所示所示装置进行电解实验。A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液。
电解原理在化学工业上有着广泛的应用,按下图所示所示装置进行电解实验。A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液。
工作一段时间后:
(1)A极附近可观察到的现象是_____________________
_______________________________________________;
检验B电极上反应产物的通常方法是_____________;
甲电池中电解反应的离子方程式是 _______________________________________;
溶液中还可能存在的离子反应方程式是 ____________________________________。
(2)甲槽溶液的pH________________________(填“增大”、“不变”或 “减小”,下同);乙槽溶液的pH_______________。当A极上收集到22.4L气体(标准状况)时,乙装置的C极上可得到____________g金属单质。
利用A、D两极上析出的物质制成的燃料电池,是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答(3)~(6):
(3)氢氧燃料电池的能量转化主要形式是 ,
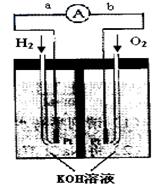 在导线中电子流动方向为 (用a、b 表示)。
在导线中电子流动方向为 (用a、b 表示)。
(4)负极反应式为 ____________。
(5)电极表面镀铂粉的原因为 __________
(6)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2=2LiH Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②先用锂吸收224L(标准状况)H2,将生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目: 来源: 题型:
如图所示,关闭阀门k,向甲中充入1.5molA、3.5molB,向乙中充入3molA、7molB,起始时,甲、乙的体积均为VL。在相同温度和有催化剂存在的条件下,两 容器中均发生下列反应:3A(g)+2B(g)![]() C(g)+2D(g);
C(g)+2D(g);![]() 。达到平衡时,乙容器中气体的体积为0.86VL。此时:
。达到平衡时,乙容器中气体的体积为0.86VL。此时:
(1)乙中B的转化率为___________________;
(2)甲中D和乙中D的物质的量比较_____________(填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间再次重新达平衡时,乙的体积为__________________________
(用含V的代数式表示,连通管中气体体积忽略不计)。

查看答案和解析>>
科目: 来源: 题型:
某研究小组用下列装置探究SO2与酸性Fe(NO3)3溶液的反应。
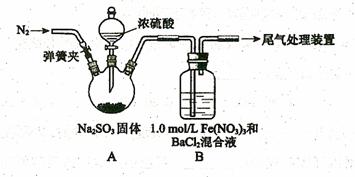 |
请回答:
(1)装置A中反应的化学方程式是 _______________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是
________________________。
(3)装置B中产生了白色沉淀,其成分是 ________,说明SO2具有 性。
(4)甲乙两同学分析B中产生白色沉淀的原因:
甲同学:在酸性条件下SO2与Fe3+反应;
乙同学:在酸性条件下SO2与NO3-反应;
①按甲同学观点,装置B中反应的离子方程式是 ,
证明该观点应进一步确认生成的新物质,其实验操作及现象是_________________________________________________________________________。
②按乙同学观点,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相
同条件下进行实验。应选择的试剂是(填序号) 。
A.![]() NaNO3溶液
NaNO3溶液
B.![]() 溶液
溶液
C.![]() 盐酸等体积混合的溶液
盐酸等体积混合的溶液
查看答案和解析>>
科目: 来源: 题型:
由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如右图(其他无关物质已略去)。请回答下列问题:
| 元素X | 易形成-1价18电子的单核离子 |
| 元素Y | 第3周期第ⅥA族 |
| 化合物Z | 所含阳离子有3个电子层 |
| 常温下0.1 mol·L-1的水溶液pH=13 |
(1)用化学方程式表示X2在工业生产上的一种用途 。
(2) 比较元素X与Y的氢化物稳定性: 比 稳定(填氢化物化学式)。
(3)将0.24 mol Y氧化物YO2和 0.11 mol氧气放入容积为1 L的密闭容器中,一定条件下反应达到平衡,得到0.12 mol YO3气体,同时放出热量11.8kJ。
①该反应平衡常数= 。
②该反应的热化学方程式为 。
(4) C能与稀硫酸反应生成能使品红溶液褪色的气体,D中所含阴、阳离子的电子层排布相同。
①写出Y与Z反应的离子方程式
②将20 mL 0.5 mol·L-1 C溶液逐滴加入到V mL 0.2 mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪色(此时Mn元素恰好变为Mn2+)。计算V= 。
(5)用石墨作电极,在隔膜电解槽中电解A的溶液,可制得Z的水溶液,请写出甲烷燃料电池(Z的水溶液为电解质溶液)负极的电极反应式
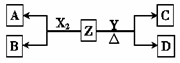
查看答案和解析>>
科目: 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。下列说法中正确的是
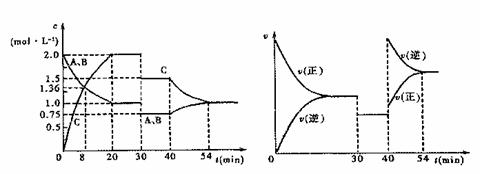
A.30min时降低温度,40min时升高温度
B.前8min A的平均反应速率为0.08mol·L—1·min—1
C.反应方程式中的x=1,正反应为吸热反应
D.该反应20min~30min的平衡常数比30min~40min的平衡常数大
查看答案和解析>>
科目: 来源: 题型:
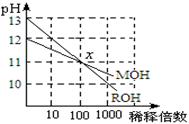
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中不正确的是
A.稀释前,c(ROH) =10 c(MOH)
B.在x点,c(M+) = c(R+)
C.在x点,ROH完全电离
D.MOH是一种弱碱
查看答案和解析>>
科目: 来源: 题型:
在相同的甲乙两密闭容器中,在相同温度下发生反应:N2(g)+3H2(g)![]() 2NH3(g);△H =-QkJ·mol—1 (Q>0)。保持T、V恒定,向甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;向乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是
2NH3(g);△H =-QkJ·mol—1 (Q>0)。保持T、V恒定,向甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;向乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是
A.2Q2<Ql<Q B.2Q2=Q1<Q C.2Q2=Q1=Q D.Ql<Q2<Q
查看答案和解析>>
科目: 来源: 题型:
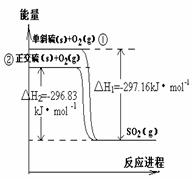
单斜硫和正交硫转化为二氧化硫的能量变化如右图所示。下列说法正确的是
A.S(s,单斜) == S(s,正交) △H = 0.33kJ·mol -1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量少297.16kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com