
科目: 来源: 题型:
向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀。已知AgCl(s)的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10。(混合后溶液的体积变化忽略不计)。试计算
(1)沉淀生成后溶液中Ag+的浓度
(2)沉淀生成后溶液的pH
查看答案和解析>>
科目: 来源: 题型:
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知:
 |
(1)写出反应类型:④__________________,⑦_________________。
(2)写出C的结构简式____________________,G的结构简式_____________________。
(3)写出反应②的化学方程式_______________________________________________。
(4)写出反应⑧的化学方程式________________________________________________。
(5)下列可检验阿司匹林样品中混有水杨酸的试剂是__________。
(a)三氯化铁溶液 (b)碳酸氢钠溶液 (c)石蕊试液
查看答案和解析>>
科目: 来源: 题型:
乙醛是重要的化工原料。目前工业上使用两种方法制取乙醛
(1)乙炔水化法: CH≡CH+H2O![]() CH3CHO
CH3CHO
(2)乙烯氧化法: CH2=CH2 + O2 ![]() CH3CHO
CH3CHO
有关信息为
| 物质 项目 | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4(催化剂) 100℃~125℃ | PdCl2~CuCl2(催化剂) 100℃~125℃ |
| 平衡转化率 | 乙炔转化率 90% | 乙烯转化率 80% |
| 反应速率 | 较 慢 | 较 快 |
| 原料来源生产工艺 | CaCO3 CaC2 | 石油裂解气 |
(1)实验室用乙醇氧化制乙醛的化学方程式_______________________ ;
(2)乙醛与新制Cu(OH)2反应的化学方程式_____________________________ 。
(3)某裂解气中各成分的体积分数分别为:甲烷5%、乙烯40%、丙烯10%、丁二烯(C4H6)10%、氢气35 % ,将其通入溴水充分反应,干燥后剩余气体的平均相对分子质量为____________(精确到0.01)。
查看答案和解析>>
科目: 来源: 题型:
在相同温度下,向a,b两密闭容器中均同时充入0.5molA和0.2molB的混合气体,起始体积均为2L,a容器保持容积不变,b容器中的活塞可上下移动,保持压强不变。发生反应3A(气)+B(气)![]() 2C(气)+D(气);10min后a中达平衡, 生成物D的浓度为0.05mol·L-1, tmin后b中达平衡,生成物D的浓度为dmol·L-1。试回答下列问题
2C(气)+D(气);10min后a中达平衡, 生成物D的浓度为0.05mol·L-1, tmin后b中达平衡,生成物D的浓度为dmol·L-1。试回答下列问题
(1)a容器中前10min平均反应速率v(C)=
(2)比较大小:d 0.05(填>、<、=、或无法比较;下同), t 10;
(3)求平衡时a容器中B物质的转化率及该温度下反应的化学平衡常数K。
查看答案和解析>>
科目: 来源: 题型:
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l) ![]() H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g) ![]() H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g) ![]() H= —110.5kJ/moL;
H= —110.5kJ/moL;
④C(s)+O2(g)=CO2(g) ![]() H= —393.5kJ/moL;
H= —393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g) ![]() H= +890kJ/moL
H= +890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是
(2)H2的燃烧热为 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+ CO(g) ![]() H=akJ/moL;
H=akJ/moL;
则a= ;该反应的熵![]() S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能![]() G=
G=![]() H—T
H—T![]() S,当
S,当![]() G<0时可自发进行。则该反应在什么条件下可自发进行 。
G<0时可自发进行。则该反应在什么条件下可自发进行 。
查看答案和解析>>
科目: 来源: 题型:
解答下列各题
(1)研究有机化合物一般要经过的几个基本步骤
①用重结晶、蒸馏、萃取等方法对有机物进行分离、提纯;
②对纯净的有机物进行元素分析,确定实验式;
③可用质谱法测定相对分子质量,确定分子式;
④可用红外光谱、核磁共振氢谱确定有机物中的官能团和各类氢原子的数目,确定结构式。其中正确的是 。
(2)已知丁基(C4H9—)有四种,下列说法直接利用了这一结论的是 。
A.C4H9Cl有四种同分异构体 B.C5H12O属于醛的同分异构体有四种
C.C4H8O2属于酯的同分异构体有四种 D.C5H10O2属于酸的同分异构体有四种
(3)乙烷受热分别生成乙烯和氢气,现有乙烷部分分解的产物,取1体积使其充分燃烧生成1.6体积的二氧化碳气体(在相同条件下测定),则乙烷的分解率是 。
查看答案和解析>>
科目: 来源: 题型:
某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
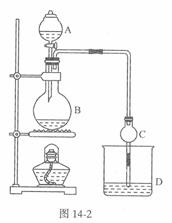 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H ②有关有机物的沸点:
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H ②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是 ;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:
。
(2)球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束后D中的现象是 .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
查看答案和解析>>
科目: 来源: 题型:阅读理解
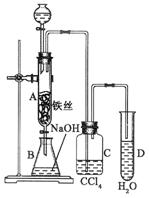 盐城作为沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我市可持续发展的重要保证。
盐城作为沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我市可持续发展的重要保证。
![]() (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
 |
 ①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
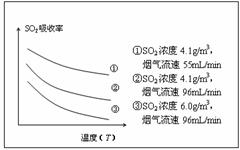
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
查看答案和解析>>
科目: 来源: 题型:
下列文字表述与离子方程式对应且正确的是
A.用石墨作电极电解NaCl溶液:2C1-+2H2OC12↑+2OH-+H2↑
B.硫氢化钠的水解:HS-+H2O![]() H3O++S2-
H3O++S2-
C.硫化钠的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D.碳酸氢钠与氢氧化钠溶液的反应:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中不正确的是
A.由红光外谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com