
科目: 来源: 题型:
某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1∶4∶8。若配制该营养液,取428 g NH4Cl,则需KCl和K2SO4的质量分别为( )
A.5![]() 3.5 g和214 g B.74.5 g和348 g
3.5 g和214 g B.74.5 g和348 g
C.74.5 g和696 g D.149 g和696 g
查看答案和解析>>
科目: 来源: 题型:
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
A.两种物质的阴离子半径都比阳离子半径小
B.与水反应时,水都做氧化剂
C.与盐酸反应都只生成一种盐
D.溶于水,所得溶液都能使无色酚酞变红
查看答案和解析>>
科目: 来源: 题型:
下列物质分别与100mL 2mol/L的盐酸恰好反应时,所得溶液的溶质的物质的量浓度的大小关系是:①镁粉 ②氧化镁 ③氢氧化镁 ④碳酸镁
A.①>②>③>④ B.①>②=④>③
C.①>④>③=② D.④>①>②=③
查看答案和解析>>
科目: 来源: 题型:
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)25 ℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是 ;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25 ℃时,在 pH =5的稀醋酸溶液中,c(CH3COO-)= (填数字表达式);
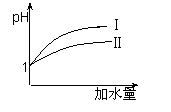 (3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水
(3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水
量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化
的曲线是 ;
(4)25 ℃时,向体积为Va mLpH=3的醋酸溶液中滴加pH=11的
NaOH溶液Vb mL至溶液恰好呈中性,则Va与的Vb关系是
Va Vb(填“>”、“<”或“=”)。
(5)25 ℃时,若向氨水中加入稀盐酸至溶液的pH=7,此时[NH4+]=a mol/L,
则[Cl-]=________。
查看答案和解析>>
科目: 来源: 题型:
有下图所示装置:
(1)装置A中b为 极,电极反应式为 ;
(2)B装置中Cu为 极,电极反应式为 ;
(3)当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为 L。

查看答案和解析>>
科目: 来源: 题型:
到目前为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH= - 25KJ/mol
3Fe2O3(s)+ CO(g)=2 Fe3O4 (s)+CO2(g) ΔH= - 47KJ/mol
Fe3O4 (s)+CO(g) =3FeO(s)+ CO2(g) ΔH=19KJ/mol
请写出CO还原FeO的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
现有25 ℃时0.1 mol/L的氨水,请回答以下问题:
(1)若向该氨水中加入少量氯化铵固体,NH3·H2O的电离平衡_______(“向左”、“向右”或“不”)移动,此时溶液中![]() ________(填“增大”、“减小”或“不变”),在该过程中,
________(填“增大”、“减小”或“不变”),在该过程中,
水的离子积常数Kw_______(填“增大”、“减小”或“不变”);
(2)若向该氨水中加入稀盐酸,使其恰好完全中和,写出反应的离子方程式
________________ _______________;
所得溶液的pH__ __7(填“>”、“<”或“=”),
用离子方程式表示其原因_______ _________,
溶液中各离子物质的量浓度由大到小的顺序为________________________________;
查看答案和解析>>
科目: 来源: 题型:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则c(OH-)= mol·L-1,
此时溶液的温度 (填“高于”“低于”或“等于”)25℃。
(2)若温度不变,滴入稀盐酸使溶液中的c(H+)=5.0×10-4mol·L-1,则此时溶液中的c(OH-)为 mol·L-1,由水电离出的c(H+)为 mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
现有可逆反应:A(g)+B(g) ![]() xC(g),在不同条件下生成物C在反应混合物中的体积分数(C%)与反应时间(t)的关系如图所示,请根据图像回答下列问题:
xC(g),在不同条件下生成物C在反应混合物中的体积分数(C%)与反应时间(t)的关系如图所示,请根据图像回答下列问题:
(1)若甲图中分别表示有催化剂和无催化剂的情况,则 曲线表示无催化剂的情况(填字母,下同);
(2)根据乙图可判断该可逆反应的正反应为 热反应(填“放”或“吸”);
(3)化学计量数x的值 (填取值范围);
(4)若丙图表示反应达到平衡后再充入惰性气体的情况,则 曲线表示恒温恒容的情况。

查看答案和解析>>
科目: 来源: 题型:
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在1 L固定体积的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,CO2的平均反应速率
v(CO2)= ;
(2)该反应的平衡常数表达式K= ;
(3)能判断该反应是否达到化学平衡状态的依据是
(多选扣分);
a.容器中压强不变 b.v正(H2)=v逆(H2O)
c.混合气体中c(H2O)不变 d.c(CO2)=c(CH3OH)
(4)下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
a.升高温度 b.将CH3OH(g)及时液化抽出
c.选择高效催化剂 d.再充入H2O(g)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com