
科目: 来源: 题型:
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |
 ①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 (填序号)。
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 (填序号)。
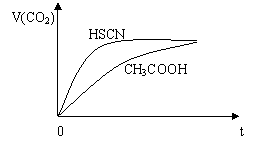
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和
20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1
NaHCO3溶液混合,实验测得产生的气体体积(V)
随时间(t)的变化如右图所示:反应初始阶段
两种溶液产生CO2气体的速率存在明显差异的原因是
。
反应结束后所得两溶液中,c(CH3COO—) c(SCN—)
(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
 a. c(CH3COO-) b. c(H+)
a. c(CH3COO-) b. c(H+)
c. Kw d. 醋酸电离平衡常数
(2)右图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别
在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属
阳离子浓度变化情况。如果向三种沉淀中加盐酸,最
先溶解的是 (填化学式)。向新生成的ZnS浊液
中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS
沉淀会转化为 (填化学式)沉淀。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷
燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
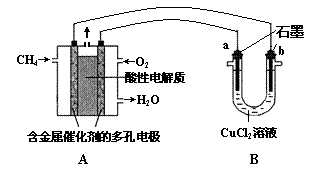
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
查看答案和解析>>
科目: 来源: 题型:
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
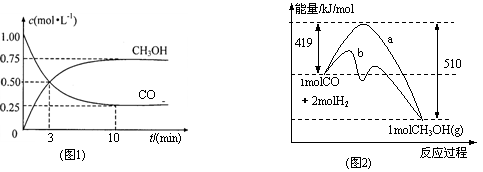 |
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是_________(选填“吸热”或“放热”)反应,写出反应的热化学方程式 。
(3)该反应平衡常数K为______________,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”)
(4)恒容条件下,下列措施中能使 ![]() 增大的有
增大的有
a.升高温度 b.充入He气
c.再充入2 molH2 d.使用催化剂
查看答案和解析>>
科目: 来源: 题型:
某铜矿石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O及CaCO3,部分步骤如下:

请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________(填离子符号),验证所
含离子所用的试剂是______________。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入
CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
![]()
![]()
![]()

如果按气流方向连接各仪器接口,你认为正确的顺序为a→______、______→______、______→ i。其中与i相连漏斗的作用是______________。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是_________(填编号)

(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;c.过滤;d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。
则铜矿石中Cu2(OH)2CO3质量分数为_____________。
查看答案和解析>>
科目: 来源: 题型:
氯化铝融盐电解法是以氯化铝为原料,以碱金属或碱土金属氯化物(含少量MgCl2、KCl、CaCl2)为电解质进行电解制取铝的方法。
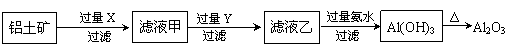
(1)氯化铝融盐电解法需要先制纯氧化铝。以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料通过以下途径提纯氧化铝:
 |
①依次写出X、Y的成分 , 。
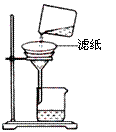
②如右图所示在实验室中进行过滤,
操作中的两处错误分别是 ;
。
(2)制备无水氯化铝的反应为:2Al2O3+6Cl2![]() 4AlCl3+3O2
4AlCl3+3O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是 。
④加入焦炭后的化学反应可表示为Al2O3+C+Cl2![]() AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
(3)现在工业上通常用电解熔融氧化铝方式制取铝,理论上生产1吨铝消耗的氧化铝的质量 (填“大于”、“小于”、“等于”)氯化铝质量。
查看答案和解析>>
科目: 来源: 题型:
现有H2SO4、Ba(OH)2、Na2CO3和氯水四种溶液,有如图所示的
相互关系,图中每条线段两端的物质可以发生化学反应。下列推断合
理的是
A. M一定是Ba(OH)2 B.Y可能是氯水
C. X一定是Na2CO3溶液 D.Z可能是H2SO4

查看答案和解析>>
科目: 来源: 题型:
下列关于有机物的说法正确的是
A.棉花和合成纤维的主要成分均为纤维素
B.煤油可由石油干馏获得,可保存少量金属钠
C.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸、乙醇
D.苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴
查看答案和解析>>
科目: 来源: 题型:
下列关于各图的叙述中,正确的是

A.图甲表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量
B.图甲表示2 mol H2(g)所具有的能量比2 molH2O(g)所具有的能量多483.6 kJ
C.图乙表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温、同浓度的NaA溶液的pH小于NaB溶液的pH
D.图乙中起始时HA的物质的量浓度大于HB
查看答案和解析>>
科目: 来源: 题型:
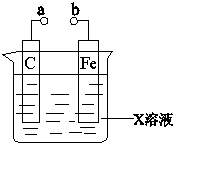
对下列装置的叙述错误的是
A.X如果是HCl,则不论a和b用导线连接还是a和b分别连接直流电源正、负极时,H+的移动方向均相同
B.X如果是硫酸铜,a和b分别连接直流电源正、负极, 一段时间后铁片质量增加
C.X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应D.X如果是NaCl,则a和b连接时,该装置可模拟生铁 在食盐水中被腐蚀的过程
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
△H<0,n(SO2)随时间的变化如表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A.当v(SO2)= v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4min内该反应的平均速率为0.005mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
查看答案和解析>>
科目: 来源: 题型:
下列有关离子的各种说法中,正确的是
A.金属钠溶于足量水中的离子方程式:Na+2H2O=Na++H2↑+2OH-
B.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、Cl-可以大量共存
C.等物质的量浓度、等体积的氨水与盐酸混和,溶液中离子浓度关系为
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中
c(K+)=c(H2X)+c(HX-)+c(X2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com