
科目: 来源: 题型:
(1)图1装置发生反应的离子方程式为

 ▲ 。
▲ 。
(2)图2装置中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为 ▲ 极,甲烧杯中铁电极的
 电极反应为 ▲ 。
电极反应为 ▲ 。
② 乙烧杯中电解反应的化学方程式为 ▲ 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 ▲ mL 。
(3)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 b处的电极反应式 ▲ ,
甲醇燃料电池的总反应化学方程式 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1) 该实验探究的是 ▲ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 ▲ > ▲ (填实验序号)。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),
则在2 min末,c(MnO4-)= ▲ mol·L-1。(假设混合溶液体积为50 mL)
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 ▲ 来比较化学反应速率。
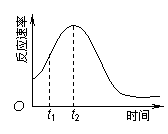
(4)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、② ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(1)家用液化气的主要成分之一是丁烷(C4H10),当2 mol丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5800kJ,试写出表示丁烷燃烧热的热化学方程式:
▲ ;
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:ks5u
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) ΔH = -24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) ΔH = -47.4 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H = +640.5 kJ·mol-1
写出CO(g)还原FeO(s)得到Fe (s)和CO2(g)的热化学反应方程式 ▲ 。

查看答案和解析>>
科目: 来源: 题型:
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某温度下,将2 mol SO2和
1 mol O2置于10 L体积可变的密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是


A.由图甲知,A点SO2的平衡浓度一定为0.04 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目: 来源: 题型:
一密闭体系中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
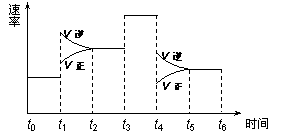

A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
查看答案和解析>>
科目: 来源: 题型:
在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH ![]() CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向正向移动, 溶液中c(H+)增大
B.加水,平衡向正向移动, c(CH3COOH)/ c(CH3COO-)增大
C. 通入少量 HCl,平衡逆向移动,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向逆向移动,溶液导电能力增强
查看答案和解析>>
科目: 来源: 题型:
对下列实验的描述正确的是
A.图1所示的实验:根据检流计(G)中指针是否偏转即可比较Zn、Cu的金属活泼性B.图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热
D.图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)![]() N2O4(g)是吸热反应
N2O4(g)是吸热反应

查看答案和解析>>
科目: 来源: 题型:
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) ![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为
NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目: 来源: 题型:
根据下表数据,比较在相同温度下,下列三种酸的相对强弱,正确的是:
| 酸 | HX | HY | HZ | ||||
| 浓度mol•L-1 | 0.1 | 0.5 | 1 | 1 | 1 | ||
| 电离度a% | 0.3 | 0.15 | 0.1 | 0.3 | 1.0 | ||
A.HX>HY>HZ B.HZ>HX>HY C.HY>HZ>HX D.HZ>HY>HX
查看答案和解析>>
科目: 来源: 题型:
通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表是一些化学键的键能。
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为
A.-1940kJ·mol-1 B.1940kJ·mol-1 C.-485kJ·mol-1 D.485kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com