
科目: 来源: 题型:
下列有关化学用语表达不正确的是
A.钙离子的电子式:Ca2+ B.CO2分子的结构式:O=C=O
C.Na的原子结构示意图:![]() D.氮气的电子式:∶N∶∶∶N∶
D.氮气的电子式:∶N∶∶∶N∶
查看答案和解析>>
科目: 来源: 题型:
下列叙述不正确的是
A.Na+、Mg2+、Al3+的氧化性依次减弱 B.RbOH、KOH、Mg(OH)2碱性依次减弱
C.H2S、H2O、HF的稳定性依次增强 D.O2-、F-、Na+、Br-的半径大小顺序为:Br- >O2->F->Na+
查看答案和解析>>
科目: 来源: 题型:
如图所示各为元素周期表的一部分,表中数字是原子序数,其中X为35的是
|
A. B.
C. D.
查看答案和解析>>
科目: 来源: 题型:
砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质
A.砷在通常状况下为固体
B.砷的最高正化合价为+5
C.砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强
D.砷化氢(AsH3)不如氨气(NH3)稳定
查看答案和解析>>
科目: 来源: 题型:
一种比黄金还要贵重百倍的 ![]() O2 气体, 不久前在我国兰州近代物理研究所制备成功,
O2 气体, 不久前在我国兰州近代物理研究所制备成功,
1 mol 这种![]() O2 气体所含有的中子的物质的量为
O2 气体所含有的中子的物质的量为
A.36 mol B.20 mol C.16 mol D.20 NA
查看答案和解析>>
科目: 来源: 题型:
甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。
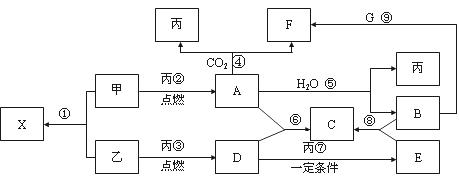
请回答:
(1) 写化学式:丙_________,E________。
(2) 用电子式表示X的形成过程______ ______________。
(3)写出A与H2O反应的化学反应方程式:__________________ ________ 。
(4)写出B与G溶液反应生成F的离子方程式:___________ _____________。
(5)在上图的反应中,不属于氧化还原反应的是(填序号)______________。
查看答案和解析>>
科目: 来源: 题型:
已知X、Y、Z、W是短周期元素中的四种非金属元素,它们的原子序数依次增大.X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置________。
(2)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为________________________。
(3)工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式________________________________,该反应中氧化剂与还原剂的物质的量比为:________________________。
(4)Z的氢化物与NaClO反应可得到肼(N2H4),该反应的化学方程式为 。
(5)肼可作为火箭发动机的燃料,与氧化剂N2O4应生成N2和水蒸气。
已知:① N2(g)+2O2(g)= N2O4 (1) △H1= -195kJ·mol-1
② N2H4(1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4 反应的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。(已知高锰酸钾与浓盐酸反应生成氯气)

(1)甲同学设计实验的依据是_____________________________________________;
请写出A与B反应的离子方程式: ;
C烧杯中的实验现象为:____________ ___;
C中所发生的化学反应方程式为: 。
(2)乙同学所设计的实验中,圆底烧瓶中发生的反应的化学方程式: __________ _______________ ________________ 。
写出B处的现象并用方程式解释原因: ____________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
对于周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(1) ②③④三种元素形成的简单离子的半径大小关系为: 。
(2)最高价氧化物水化物碱性最强的物质的化学式 ,该物质与⑤ 的单质反应的离子方程式 。
(3)常温下为液态的单质 ,写出该单质与铁反应的化学方程式 。
(4)1g ⑦的单质完全燃烧,放出的热量为9.25KJ,写出⑦的单质燃烧热的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
I.请指出下列过程需要破坏的作用力
①离子键 ②极性共价键③非极性共价键④氢键⑤分子间作用力
(1)干冰熔化 ; (2)氢氧化钠溶于水________;
(3)过氧化钠溶于水 ; (4)氯化氢气体溶于水____;
(5)冰熔化______________;
II.写出下列物质的电子式:
(1)N2 (2)Na2O2 (3) NH4Cl
(4) MgF2 (5) CO 2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com