
科目: 来源: 题型:
用铁片与2mol/L稀硫酸反应制取氢气时,下列措施不能使氢气生成速率减小的是( )
A.加少量CH3COONa固体 B.加水
C.加少量CuSO4固体 D.加等量等浓度Na2SO4溶液
查看答案和解析>>
科目: 来源: 题型:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的
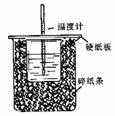 装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品
是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+ 4 NO2 (g)= 4 NO (g)+ CO2 (g)+ 2 H2O (g)ΔH= -574 kJ · mol-1
CH4(g)+ 4 NO (g)= 2 N2(g)+ CO2 (g)+ 2 H2O (g)ΔH= -1160 kJ· mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为
(阿伏加德罗常数的值用NA表示),放出的热量为 kJ。
(2)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_______________________________。
(3)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成(SiO2)和水。已知室温下10 g甲硅烷自燃放出热量446 kJ,表示其燃烧热的热化学方程式为:
______________________________________________________________________。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个反应的热化学方程式:
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
请根据反应:Cu + 2FeCl3 = CuCl2 + 2FeCl2 ,设计一个原电池。
(1)画出装置图,标明两极材料和电解质溶液,并指出正、负极。
(2)写出两电极上的电极反应式。
查看答案和解析>>
科目: 来源: 题型:
2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
 请回答下列问题:
请回答下列问题:
(1) 图中A、C分别表示________________、________________,
E的大小对该反应的反应热有无影响?______________。
(2)图中ΔH=____________ kJ·mol-1;
(3) 反应速率v(SO2)为0.05 mol · L-1 · min-1,则v(O2)=____________mol · L-1 · min-1、
v(SO3)=____________mol · L-1 · min-1;
(4) 已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=________。
查看答案和解析>>
科目: 来源: 题型:
下列物质:①N2 ②Na2O ③NH3 ④CO2 ⑤Na2O2
⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
回答下列问题:(填序号)
(1)只含离子键的是 ;(2)只含极性键的是 ;
(3)含有极性键和非极性键的是 ;(4)含有非极性键的离子化合物是 ;
(5)含有极性键的离子化合物是 。
查看答案和解析>>
科目: 来源: 题型:
短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数
| 乙 | 丙 | 丁 | |
| 甲 | 戊 |
是其周期序数的三倍。回答下列问题:
(1)甲在元素周期表中的位置是 。
(2)原子半径:甲 丁(填“>”或“<”)。
(3)乙与戊组成化合物的电子式为 ,其中化学键的类型是 (填“极性”或“非极性”)共价键。
(4)元素的非金属性:甲 丙(填“>”或“<”),下列事实能说明该结论的是 。
A、丙的氢化物稳定,甲的氢化物不稳定
B、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸
C、丙的最高价氧化物对应的水化物易溶于水,甲的难溶
(5)丙的单质的电子式为 ,乙与丁的原子构成的三原子分子的电子式为 。
查看答案和解析>>
科目: 来源: 题型:
已知:Fe2O3(s) + ![]() C(s) =
C(s) = ![]() CO2(g) + 2 Fe(s) ΔΗ=+234.1 kJ·mol-1
CO2(g) + 2 Fe(s) ΔΗ=+234.1 kJ·mol-1
C(s) + O2(g) = CO2(g) ΔΗ=-393.5 kJ·mol-1
则2 Fe(s)+ ![]() O2(g) = Fe2O3(s) 的ΔΗ 是:
O2(g) = Fe2O3(s) 的ΔΗ 是:
A.-169.4kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-824.4 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+ 的核外电子层结构相同。下列化合物中同时存在离子键和共价键的是:
A.Z2Y B.Z2Y2 C.X2Y2 D.ZYX
查看答案和解析>>
科目: 来源: 题型:
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:
P—P a kJ·mol—1、P—O b kJ·mol—1、P=O c kJ·mol—1、O=O d kJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是:
A.(4a+5d-4c-12b)kJ·mol—1 B.(4c+12b-4a-5d)kJ·mol—1
C.(4c+12b-6a-5d)kJ·mol—1 D.(6a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com