
科目: 来源: 题型:阅读理解
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH | 1.76×10-5 | |
| H2CO3 | H2CO3 HCO | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH | 1.1×10-10 | |
| H3PO4 | H3PO4 H2PO HPO | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3·H2O | NH3·H2O | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2 | 5.6×10-12 |
回答下列问题:
I.(1)由上表分析,若①CH3COOH ②HCO![]() ③C6H5OH ④H2PO
③C6H5OH ④H2PO![]() 均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式: ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是 ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c(NH4+)= c(C6H5O-)+ c(C6H5OH)
 | |||
 | |||
(5)如左上图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
① T1 T2(填>、=、<);
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是 。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
II.平衡常数的计算:
(1)用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线右上图。其中①点所示溶液中c(CH3COO-)=2c(CH3COOH)
③点所示溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+)
则CH3COOH的电离平衡常数Ka= 。
(2)水解反应是典型的可逆反应。水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:Kh= 。
(3)MgCl2溶液和氨水混合后存在下列化学平衡:Mg2+(aq)+2NH3·H2O(aq)![]() 2NH4+(aq)+Mg(OH)2(s)
2NH4+(aq)+Mg(OH)2(s)
试列出该反应平衡常数K与Kb(NH3·H2O)、Ksp[Mg(OH)2]的关系式并计算: 。
查看答案和解析>>
科目: 来源: 题型:
某班学生对BeCl2是离子化合物还是共价化合物进行集体探究,从经验看铍是金属元素,易失去电子,氯元素易得到电子,请回答以下问题:
(1) Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为 化合物。
(2)工业上制取BeCl2方法是:将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式 。
(3)经实验验证,熔融的BeCl2不能导电,说明它是 化合物;BeCl2能溶于水,水溶液能导电,因它在溶液中能电离,写出它的电离方程式 。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,判断BeCl2应与 (填MgCl2或AlCl3)化学性质更相似。
(5)0.1mol氢氧化铍恰好能和100mL0.2mol/L的氢氧化钠溶液发生反应,写出反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
下表是元素周期表的一部分,表中列出了8种元素在周期表中的位置。请回答有关问题。
|
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ⑤ | ⑥ | ⑦ | ||||
| 3 | ② | ④ | |||||
| 4 | ① | ③ | ⑧ |
(1)写出元素⑧的基态原子核外电子排布式 ;
(2)元素⑤⑥⑦第一电离能由大到小的顺序是 (用电离能和元素符号表示);
(3)元素①、②、③对应的氧化物熔点由高到低的顺序排列是 (填化学式);
(4)元素③、②、④形成的单质晶体的熔点升高的原因是
。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
 Ⅰ.利用右图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
Ⅰ.利用右图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
⑴写出负极的电极反应式 。
⑵某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3: 。
⑶为了探究假设1、2,他采取如下操作:
①取0.01mol/L FeCl3溶液2mL于试管中,加入过量铁粉;
②取操作①试管的上层清夜加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红;
据②、③、④现象得出的结论是 。
⑷该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施 。
 Ⅱ.利用右图装置作电解50mL 0.5mol/L的CuCl2溶液实验。
Ⅱ.利用右图装置作电解50mL 0.5mol/L的CuCl2溶液实验。
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色;
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
⑴分析实验记录A中试纸颜色变化,用离子方程式解释:① ;
② 。
⑵分析实验记录B中浅蓝色固体可能是 (写化学式),试分析生成该物质的原因 。
查看答案和解析>>
科目: 来源: 题型:
下列最终有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:
c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液成酸性:
c(CH3COO-)<c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-![]() 4OH-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e- = Cu2+

查看答案和解析>>
科目: 来源: 题型:
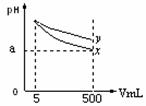
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH
与溶液体积(V)的关系如图所示,下列结论正确的是( )
A.相同温度下,x的的电离平衡常数小于y
B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
 |
查看答案和解析>>
科目: 来源: 题型:
对于可逆反应N2(g)+3H2(g)![]() 2NH3(g);△H<0,下列研究目的和示意图相符的是( )
2NH3(g);△H<0,下列研究目的和示意图相符的是( )
| A | B | C | D | |
| 研究目的 | 压强对反应的 影响(P2>P1) | 温度对反应的影响 | 增加N2的浓度对反应的影响 | 催化剂对反应的 影响 |
| 图示 |
|
|
|
|
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.HCl和NaOH反应的中和热为ΔH=–57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
为ΔH=2×(–57.3)kJ/mol
B.CO(g)燃烧热ΔH=–283.0kJ/mol,则2CO2(g) = 2CO(g) + O2(g)反应的 ΔH=+2×283.0kJ/mol
C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会 使测得的值偏大
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目: 来源: 题型:
最近发现一种由某金属原子M和非金属原子N构成的气态团簇分子,如图所示.顶角和面心的原子是M原子,棱的中心和体心的原子是N原子,它的化学式为( )

A.M4N4 B.MN C.M14N13 D.M4N5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com