
科目: 来源: 题型:
下列行为不符合“促进低碳经济”宗旨的是 ( )
A.尽量使用含12C的产品,减少使用含13C或14C的产品
B.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
C.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气
查看答案和解析>>
科目: 来源: 题型:
高氯酸钾广泛用于火箭及热电池业。实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到。
(1)写出实验室制取高氯酸钾的化学方程式:___ _。
(2)用蒸馏水多次洗涤晶体的目的是______________ __。
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体, I、使固体全部溶解。II、在100oC时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体![]() 。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品
。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品![]() 。IV、重结晶得KNO3纯品
。IV、重结晶得KNO3纯品![]() 。
。
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10oC | 80.5 | 20.9 | 35.7 | 31.0 |
| 100oC | 175 | 246 | 39.1 | 56.6 |
①操作III中采用减压过滤,装置如右图所示,仪器A和B的名称分别是
,
②该装置有三处错误,分别是
,
③若实验过程中发现倒吸现象,应采取的措施是 。
(4) KNO3晶体纯品的产率 。 
查看答案和解析>>
科目: 来源: 题型:
控制和治理CO2、SO2是解决温室效应、减少酸雨的有效途径,有学者设想以如图所示装置用电化学原理将他们转化为重要化工原料。请回答:
(1)若A为CO2,B为H2,C为CH3OH,则负极是 (填“A”或“B”),正极反应式为 。
(2)若A为SO2,B为O2,C为H2SO4。则负极反应式
为 。
电池总反应式为 。
科研人员希望每分钟从C处获得100mL10mol/L H2SO4 ,A处通入废气(SO2的体积分数为1%)的速率为 L/min(标准状况)。

查看答案和解析>>
科目: 来源: 题型:阅读理解
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
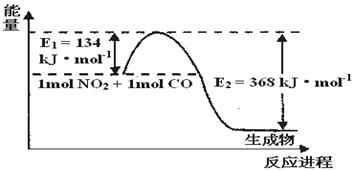
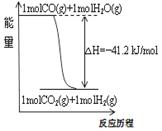
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
![]() N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1.K2的大小,K1_ K2(填写“>”.“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_ ___(填序号字母):
a.容器内N2.H2.NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2.H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正_ _ v(N2)逆(填写“>”.“=”或“<”)
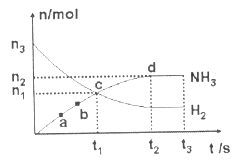
 (3)一定条件下,在体积为VL的密闭容器中进行反应:
(3)一定条件下,在体积为VL的密闭容器中进行反应:![]()
![]()
![]() ,其n(H2)和n(NH3)随时间变化的关系如下图(左)所示。从开始到平衡时,反应的平均速率用H2的浓度变化表示为
,其n(H2)和n(NH3)随时间变化的关系如下图(左)所示。从开始到平衡时,反应的平均速率用H2的浓度变化表示为![]() 。
。
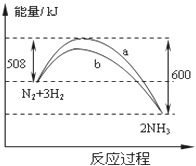
(4)在一定温度时,N2与H2反应过程中能量变化的曲线如第5页下方右图所示,下列叙述正确的是( )
A.逆反应的活化能不小于92kJ/mol B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放热增多 D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目: 来源: 题型:
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量浓度分别为A和B,则A和B的关系为________。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是产生白色沉淀,且红色褪去,其原因是___________________________。
(3)若AmBn的溶液为弱酸强碱盐的溶液,则其水解的离子方程式是_________________。
查看答案和解析>>
科目: 来源: 题型:
关于下列各图的叙述错误的是 ( )
 |

| 化学方程式 | 平衡常数K |
| F2+H2 | 6.5×1095 |
| Cl2+H2 | 2.6×1033 |
| Br2+H2 | 1.9×1019 |
| I2 + H2 | 8.7×102 |
图 甲 表 乙 图 丙
A.已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.常温下0.4 mol·L-1 HB溶液和0.2 mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)> c(Na+)>c(H+)>c(OH-)
C.常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况
查看答案和解析>>
科目: 来源: 题型:
可逆反应mA(g)+nB(g)![]()
![]() pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示。
pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示。
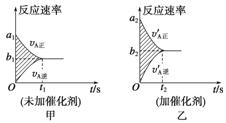
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2
⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图Ⅱ中阴影部分面积更大
以上所列正确的为 ( )
A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
查看答案和解析>>
科目: 来源: 题型:
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液,则下列说法中,正确的是 ( )
A.25℃时,0.1 mol/L HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目: 来源: 题型:
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是 ( )
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3[来源: .Com] | K1=4.3×10-7 |
| K2=5.6×10-11 |
A.c(ClO-)>c(HCO![]() )>c(H+)
)>c(H+)
B.c(HCO![]() )>c(ClO-)> c(Na+)
)>c(ClO-)> c(Na+)
C.c(HClO)+c(ClO-)=c(HCO![]() )+c(H2CO3)+c(CO32-)
)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)=c(HCO![]() )+c(ClO-)+c(OH-)
)+c(ClO-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述错误的是 ( )

A. HA是一种强酸 B.原溶液中HA的物质的量浓度为HB的10倍
C.x点,HB未完全电离 D.x点,c(A-)=c(B-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com