
科目: 来源: 题型:
下列各组物质中,属于同分异构体的是
A.CH3CH2CH3和CH3CH2CH2CH3 B.H2NCH2COOH和CH3CH2NO2
C.CH3CH2COOH和CH3COOCH2CH3 D.CH2=CHCH2CH3和CH2=CHCH=CH2
查看答案和解析>>
科目: 来源: 题型:
下列各组顺序的排列不正确的是
A.热稳定性:HCl>H2S>PH3 B.若离子半径:R2->M+,则原子序数:R >M
C.酸性强弱:H4SiO4<H2CO3<CH3COOH D.熔点:金刚石>食盐>干冰
查看答案和解析>>
科目: 来源: 题型:
下列关于化石燃料的加工说法正确的是
A.石油裂化主要得到乙烯 B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
D.煤的气化是物理变化,是高效、清洁地利用煤的重要途径
查看答案和解析>>
科目: 来源: 题型:
下列表示物质结构的化学用语或模型正确的是
A.8个中子的碳原子的核素符号:12C B.HF的电子式:![]()
C.Cl-离子的结构示意图: D.CH4分子的比例模型:
D.CH4分子的比例模型:
查看答案和解析>>
科目: 来源: 题型:
目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点。
(1) 将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,配平下列离子方程式:
( )Fe(OH)3 + ( )ClO- + OH- == ( )FeO42- + ( )Cl- + ( )H2O
(2) 用Fe做阳极,Cu做阴极,NaOH溶液做电解液,用电解的方法也可制得Na2FeO4,则电解过程中阳极的反应式为 。
(3) 某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):

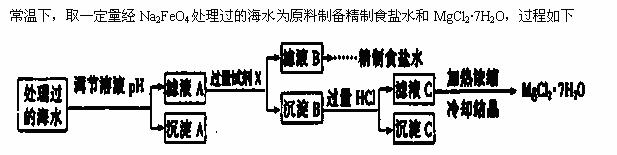 注:离子浓度小于10-5mol/L 可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=1.0×10-12;
注:离子浓度小于10-5mol/L 可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=1.0×10-12;
操作过程中溶液体积的变化忽略不计。
①表格中的a 0.16 (填“<”或“=” 或“>”)。
②沉淀A的组成为 (填化学式);在调节溶液pH时,理论上应调节的pH的范围是
_____________________。
③加入的过量试剂X为_______ (填化学式)。
④加入过量HCl的作用为 。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质
(1)利用Ⅰ、Ⅱ装置制取气体(K2关闭、K1打开),甲同学认为:利用Ⅱ装置可以收集H2等气体,但不能收集O2 、NO2或NO气体,其理由是 。
(2)乙同学认为:利用Ⅱ装置作简单改进(但不改变瓶口朝向),
也可以收集O2、NO等气体,但不能收集NO2气体,其改进的方法
是 。
(3)丙同学想利用上述装置比较H2SO4、H2CO3和H2SiO3的酸性强弱(不必再选用其它酸性溶液,且通过一次实验就可以达到目的)。实验时,K1关闭、K2打开。锥形瓶内装 固体,装置C(试管)中所盛的试剂是 ;实验确认H2SO4、H2CO3和H2SiO3的酸性强弱出现的现象是
。
(4)丁同学想证明氧化性:Ca(ClO)2 >Cl2 > Br2,实验时,K1关闭、K2打开,则在A中加__________;B中加Ca(ClO)2,C中加________溶液,观察到C中的现象是__________________________;但是此装置在完成这个实验时尚存不足,其不足是_________________________。

查看答案和解析>>
科目: 来源: 题型:
(1)常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略溶液体积的变化),测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH________(填“>7”、“<7”或“无法确定”)。
(3)常温下测得浓度为0.1mol·L-1的HA溶液的pH=3,则HA的电离常数Ka=
 (4)工业上用氯化铁溶液腐蚀铜制电路板。如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答下列问题
(4)工业上用氯化铁溶液腐蚀铜制电路板。如下图,横坐标为溶液pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答下列问题
①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol/L,
今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金
属阳离子为_____________。
②从图中数据计算可得Fe(OH)2的溶度积:
Ksp[Fe(OH)2]=___________。
查看答案和解析>>
科目: 来源: 题型:
人体血液里Ca2+的浓度一般采用g/cm3来表示(即1 cm3血样中含有的Ca2+的质量)。抽取 一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
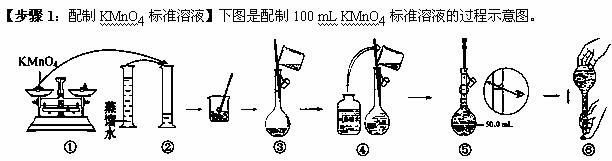 (1)请你观察图示判断,其中不正确的两项操作有 (填序号);
(1)请你观察图示判断,其中不正确的两项操作有 (填序号);
(2)其中确定100 mL溶液体积的仪器是__________________
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将
______(填“偏大”或“偏小”)。
【步骤2:测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L 酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)写出草酸与酸性KMnO4溶液反应的离子方程式 。
(5)滴定的终点为 。
(6)经过计算,血液样品中Ca2+的浓度为__________g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com