
科目: 来源: 题型:
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体。含U的化合物的焰色为紫色。试回答下列问题:
(1)U单质的原子堆积方式为__________________,Y的价电子排布式为__________________。
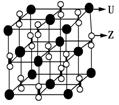 (2)化合物甲由Z、U两元素组成,其晶胞如右图所示。
(2)化合物甲由Z、U两元素组成,其晶胞如右图所示。
①甲的化学式为____________。
②下列有关该晶体的说法中正确的是________(选填选项字母)。
A.每个晶胞中含有14个U+ 和13个Z2-
B.晶体中每个U+ 周围距离最近的U+ 有6个
C.该晶体属于离子晶体
③甲的密度为a g·cm-3,则晶胞的体积是_____________ m3(只要求列出计算式,阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.请按下列要求写出相应粒子的电子排布式,并回答有关问题:
(1)写出基态原子或离子的电子排布式:
Fe3+_________________;Cu _______________。
(2)比较 Fe2+ 与Fe3+的化学稳定性:Fe2+ Fe3+;半径大小:Fe2+ Fe3+(均填“>”或“<”)。
Ⅱ.(1)在第三周期中,第一电离能最小的元素是______,电负性最大的元素是_______(用元素符号表示)。
(2)第三周期原子中p轨道半充满的元素是_______ (用元素符号表示)。
(3)第二周期原子中,未成对电子数等于其周期序数的原子有 (用元素符号表示)。
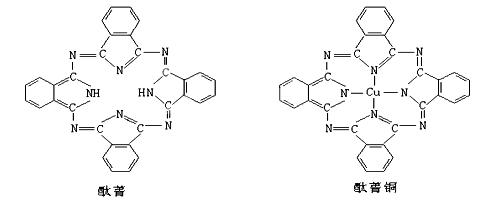
Ⅲ.酞菁与酞菁铜染料分子结构如下图:酞菁分子中氮原子采用的杂化方式有: ,并在下图相应位置上标出酞菁铜结构中铜原子周围的配位键:
查看答案和解析>>
科目: 来源: 题型:
(1)甲醛易溶于水的原因是_______________________________________。
(2)沸点:甲醇_______甲醛(填“>”或“<”);原因:_________________________。
(3)为了减缓温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2 。若有2mol CH4生成,则有 mol σ键和 mol π键断裂。
(4)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为____________________________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
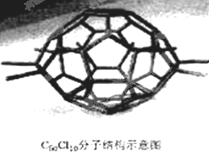
厦门大学郑兰荪院士合成了C70Cl10富勒烯足球状分子,如下图,它是由C70分子与Cl2发生加成反应得到的。在C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,70个碳原子组成若干个正六边形和正五边形。则有关说法中不正确的是
A.C70的熔点比石墨的熔点低
B.C70和金刚石是同素异形体
C.C70分子中含有70个σ键,35个π键
D.C70Cl10分子中共用电子对数目为145个
查看答案和解析>>
科目: 来源: 题型:
下表中列出对应物质的熔点,有关判断正确的是
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920 ℃ | 97.8 ℃ | 1291 ℃ | 190 ℃ | 2073 ℃ | -107 ℃ | -57 ℃ | 1723 ℃ |
A.只要含有金属阳离子的晶体就一定是离子晶体
B.AlF3 和AlCl3 晶体熔化时,克服的微粒间作用力类型相同
C.同族元素的氧化物不可能形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体高
查看答案和解析>>
科目: 来源: 题型:
现有四种元素的基态原子,它们的核外电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
查看答案和解析>>
科目: 来源: 题型:
已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被H2O分子取代,所形成离子[Co(NH3)4(H2O)2]3+的结构种数为
A.2种 B.3种 C.4种 D.6种
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是
A.氨是极性分子,其在水中的溶解度很大
B.DNA中的碱基互补配对是通过氢键来实现的
C.气体单质中,一定有σ键,可能有π键
D.元素“氦、铷、铯”等是用光谱分析方法发现的
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.3p3表示3p能级有三个轨道
B.基态碳原子的价电子排布图:![]()
C.冰和固体碘晶体中相互作用力不完全相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分
子式为EF或FE

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com