
科目: 来源: 题型:
下列说法不正确的是( )
A. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
B. 将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
C. 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-)
D. 0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
用0.1mol/L的硫酸溶液滴定未知浓度的NaOH溶液,导致测定的NaOH浓度值偏大的操作有( )
A、将待测液NaOH溶液取到锥形瓶后,露置空气中较长时间,以酚酞为指示剂测定
B、以甲基橙为指示剂,当甲基橙变红时停止滴定
C、移液管用蒸馏水冲洗后直接移取待测液
D、滴定终点读数时俯视
查看答案和解析>>
科目: 来源: 题型:
下列溶液一定呈中性的是( )
A.溶液中![]() (KW为溶液所处温度时水的离子积常数)
(KW为溶液所处温度时水的离子积常数)
B.pH=7的溶液 C.使石蕊试液呈紫色的溶液
D.等体积0.1 mol·L-1 硫酸与0.1 mol·L-1的氢氧化钠溶液混合后的溶液
查看答案和解析>>
科目: 来源: 题型:
COCl2(g) ![]() CO(g)+Cl2(g) △H>0,当反应达到平衡时,下列措施能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0,当反应达到平衡时,下列措施能提高COCl2转化率的是
A.恒容通入惰性气体 B.恒压时通入惰性气体
C.恒容通入COCl2气体 D.加催化剂
查看答案和解析>>
科目: 来源: 题型:
下列变化不能用勒夏特列原理解释的是( )
A.向H2S水溶液中加入NaOH有利于S2-增多
B.H2、I2、HI混合气体加压后颜色变深
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是( )
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是( )
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=30 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )
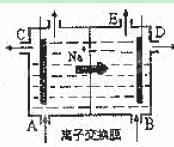
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时首先加Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
对下列实验的描述正确的是( )

A.图1:根据检流计(G)中指针的偏转方向可比较Zn、Cu的金属活泼性
B.图2:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图3:根据温度计读数的变化测定浓硫酸和NaOH溶液反应的中和热
D.图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)![]() N2O4(g)是吸热反应
N2O4(g)是吸热反应
查看答案和解析>>
科目: 来源: 题型:
铜锌原电池工作时,下列叙述正确的是( )
A、正极反应为:Zn—2e-=Zn2+
B、在外电路中,电子从铜片流向锌片
C、负极发生还原反应
D、盐桥中的K+移向CuSO4溶液
查看答案和解析>>
科目: 来源: 题型:
1g H2的热值为142.9KJ热量,下列反应的热化学方程式正确的是( )
A.H2 + O2 = 2H2O △H= -571.6KJ/mol
B.H2 (g)+ 1/2O2(g)= H2O (l) △H= -142.9KJ/mol
C.H2 (g)+ 1/2O2(g)= H2O (l) △H= -285.8KJ/mol
D.2H2(g)+ O2(g) = 2H2O (g) △H= -571.6KJ/mol

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com