
科目: 来源: 题型:
有关实验的叙述,正确的是( )
A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D. 读取滴定管内液体的体积,俯视读数导致读数偏小
查看答案和解析>>
科目: 来源: 题型:
有4种混合溶液,分别由等体积0.1mol·L-1 的两种溶液混合而成,
①NH4Cl与CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)。
下列各项排序正确的是( )
A.pH: ②<①<③<④ B.pH:①<③<②<④
C.c(NH4+):①<③<②<④ D.c(NH4+): ①<③<④<②
查看答案和解析>>
科目: 来源: 题型:
已知反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10L体积可变的密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10L体积可变的密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
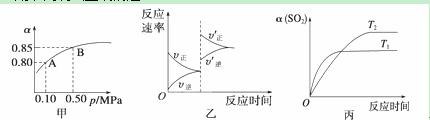
A.由图甲知,A点SO2的平衡浓度一定为0.04 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目: 来源: 题型:
常温下,将pH=3的强酸溶液和PH=12的强碱溶液混合,当混合液的pH等于11时,强酸与强碱溶液的体积比是( )
A.9∶2 B.1∶9 C.10∶1 D.9∶1
查看答案和解析>>
科目: 来源: 题型:
通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表是一些化学键的键能。
| 化学键 | C—H | C—F. | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为( )
A.-1940kJ·mol-1 B.1940kJ·mol-1 C.-485kJ·mol-1 D. 485kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) ![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,2H2O(g) = 2H2 (g)+O2(g),此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目: 来源: 题型:
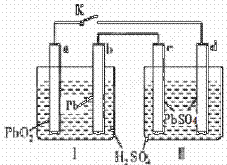
铅蓄电池的工作原理为![]() 研读下图,下列判断不正确的是( )
研读下图,下列判断不正确的是( )
A.K闭合时,d电极反应式:
PbSO4+2H2O-2e-= PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.2mol
C.K闭合时,Ⅱ中SO42- 向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目: 来源: 题型:
下列应用与盐类的水解无关的是( )
A.纯碱溶液可去除油污 B.NaCl可用作防腐剂和调味剂
C.TiCl4溶于大量水加热制备TiO2 D.FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体
查看答案和解析>>
科目: 来源: 题型:
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)![]() 2Z(g) 一定达到化学平衡状态的是( )
2Z(g) 一定达到化学平衡状态的是( )
① 容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目: 来源: 题型:
室温条件下进行下列各组实验,其中的观察要点不能说明醋酸是弱电解质的是( )
| 选项 | 实验方案 | 观察要点 |
| A | 等浓度的醋酸与氢氧化钠溶液反应 | 恰好反应时的体积比 |
| B | 醋酸溶液中加入醋酸钠固体 | 溶液pH的变化 |
| C | 等体积等浓度的盐酸和醋酸分别和等量镁条反应 | 产生H2的起始速率 |
| D | 将pH= 4的醋酸稀释成PH= 6的溶液 | 加H2O的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com