
科目: 来源: 题型:阅读理解
铜陵有色股份有限公司电线电缆厂属国家电线电缆、绕组线行业专业生产厂。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。
甲同学根据已学知识,提出了一套回收方案:
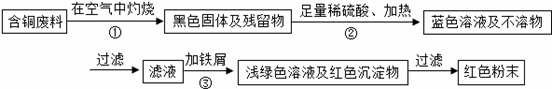
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2≜2CuSO4+2H2O),于是他提出了另一套方案:

(1) 甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
① ; ③ 。
(2)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)的方案更合理。理由是:_________________________________________________。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。
丁又提出了疑问:“如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?”。
请提出你的想法: 。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。如果直接排放掉滤液,不仅造成了浪费,还会 。
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g,需水 mL(水的密度为1.0g/mL),在实验室中稀释浓硫酸时,是如何操作的:
。
查看答案和解析>>
科目: 来源: 题型:
废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
| Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al | |
| 罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | - | - | - | 其余 |
| 罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | - | 0.1 | 0.25 | 其余 |
| 拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
为了验证罐身的组成成分,进行了如下实验:
【实验仪器与药品】
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H5IO6,弱酸)
【实验方案】
实验预处理。将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
【实验过程】分别向试管a、b中加入少量上述易拉罐片,进行如下操作:

请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有___________________________。
(2)沉淀A的成分为 。
(3)操作③观察到的现象为__________________________________________________;
反应的离子方程式为 、 、_______________________。
(4)若试管a、b中取样相同,则分别加入足量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a)________V(b)(填“<”、“>”或“=”)。
![]()
查看答案和解析>>
科目: 来源: 题型:
化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。
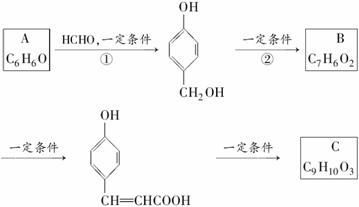
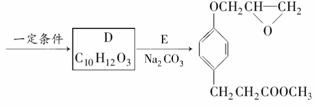
M
已知:RONa+R′Cl―→ROR′+NaCl
根据题意完成下列填空:
(1)写出反应类型。反应①_________________ 反应②________________
(2)写出结构简式。A_________________ _ C_________________

_____________________________________________________________。
(4)由C生成D的另一个反应物是________,反应条件是____________。
(5)写出由D生成M的化学反应方程式。
______________________________、_______________________________
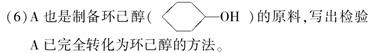 ___________________________。
___________________________。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲由X、Z、Q三种元素组成,常温下0.1 mol/L甲溶液的pH=13。工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成;请回答以下问题:
(1)Q的原子结构示意图为________。
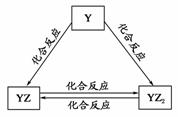
(2)Y元素的单质能发生如图所示的转化,则Y元素为________(用元素符号表示)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是_______________________ (用离子方程式和必要的文字说明)。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为:__________________。
②Q、W两种元素金属性的强弱为Q________W(填“<”、“>”);下列表述中证明这一事实的是________。
a.Q的单质的熔点比W单质低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c.W的原子序数大
查看答案和解析>>
科目: 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A.9.0L B.13.5L C.15.7L D.16.8L
查看答案和解析>>
科目: 来源: 题型:
向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是( )
A.c=![]() B.p=m+
B.p=m+![]()
C.n=m+17Vc D.![]() m<p<
m<p<![]() m
m
查看答案和解析>>
科目: 来源: 题型:
具有显著抗癌活性的10-羟基喜树碱的结构如图所示。下列关于10-羟基喜树碱的说法正确的是( )
A.分子式为C20H16N2O5
B.不能与FeCl3溶液发生显色反应
C.不能发生酯化反应
D.一定条件下,1 mol该物质最多可与1 mol NaOH反应

查看答案和解析>>
科目: 来源: 题型:
某储能电池的原理如图所示,溶液中c(H+)=2.0 mol·L-1,阴离子为SO![]() ,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色。下列叙述正确的是( )
,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色。下列叙述正确的是( )
A.当右槽溶液颜色由绿色变为紫色时,电池中能量转化形式为化学能转化为电能
B.充电过程中,a极的反应式为VO2+-e-+H2O===VO![]() +2H+
+2H+
C.储能电池a、b两极间的电解质溶液中通过电子的定向移动形成闭合回路
D.放电时,当转移的电子数为6.02×1023时,从右槽迁移进入左槽的H+的物质的量为2 mol

查看答案和解析>>
科目: 来源: 题型:
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-===X+2H+。下列说法中正确的是( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为O2+4e-+2H2O===4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应式为2CH3CH2OH+O2===2CH3CHO+2H2O
查看答案和解析>>
科目: 来源: 题型:
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1 mol·L-1HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com