
科目: 来源: 题型:
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g) ![]() CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H =![]() —571.6kJ/mol;
—571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —566.0kJ/mol
①计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H = ▲ 。
②若在恒温恒容的容器![]() 内进行反应CO(g)+2H2(g)
内进行反应CO(g)+2H2(g) ![]() CH3OH(g),下列表示该反应达到平衡状态的标志有 ▲ (填字母序号)。
CH3OH(g),下列表示该反应达到平衡状态的标志有 ▲ (填字母序号)。
A.容器中混合气体的密度不变化 B.CO百分含量保持不变
C.容器中混合气体的压强不变化 D.有1个H—H键生成的同时有 3个C—H键生成
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g) ![]() H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K = 1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K = 1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应
 v(正) ▲ v(逆)(填“>”、“<”或“=”);
v(正) ▲ v(逆)(填“>”、“<”或“=”);
 ②若反应温度不变,达到平衡后,H2O的转化率为 ▲ 。
②若反应温度不变,达到平衡后,H2O的转化率为 ▲ 。
(3)某实验小组设计了如右图所示的甲醇燃料电池装置。
①该电池工作时,OH— 向 ▲ 极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池
负极反应的离子方程式为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
化合物C是一种合成药品的中间体,其合成路线为:
|
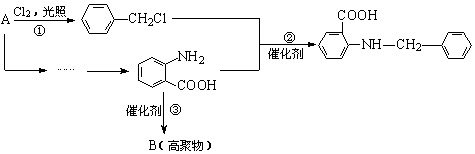
已知:

(1)写出![]() 中官能团的名称 ▲ 。
中官能团的名称 ▲ 。
(2)写出反应①的化学方程式 ▲ 。
(3)反应②属于 ▲ 反应(填有机反应类型)。
(4)产物C中有_____▲___种不同环境的的氢原子。
(5)写出满足下列条件的![]() 的同分异构体的结构简式 ▲ 。
的同分异构体的结构简式 ▲ 。
① 苯环上的一取代产物只有两种;
② 具有弱碱性,能发生银镜反应;
③ 水解后的产物能与FeCl3溶液发生显色反应。
(6)请你设计由A合成B的合成路线。
提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下:
![]()
查看答案和解析>>
科目: 来源: 题型:
从含镁、钾盐湖水中蒸发最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O),它在空气中极易潮解、易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5. 550g样品溶于水,配成l00mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 580g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是 ▲ 。
(2)已知某温度下Mg(OH)2的Ksp =6.4 ×l0-12,当溶液中c(Mg2+)≤1.0×10 -5mol·L-1可视为沉淀完全,则应保持溶液中c(OH-)≥ ▲ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
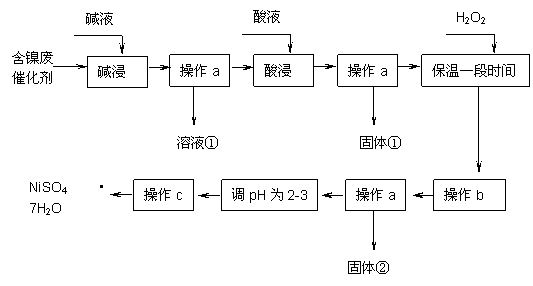 |
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 ▲ 。
(2)“碱浸”过程中发生的离子方程式是 ▲ , ▲ 。
(3)“酸浸”时所加入的酸是 ▲ (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 ▲ 。
(4) 操作b为调节溶液的pH,你认为pH的最佳调控范围是 ▲ 。
(5)“调pH为2~3”的目的是 ▲ 。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
CaCO3广泛存在于自然界,是一种重要的![]() 化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
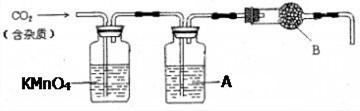
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol·L-1),需要的玻璃仪器有 ▲
(2)上述装置中,A是 ▲ 溶液,其作用是 ▲ 。
(3)上述装置中,B物质是 ▲ 。
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
①从物质分类的角度分析,石蜡属于有机物中的 ▲ 类,为了将石蜡从饭盒中溶出,应选用下列试剂中的 ▲ 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d 正已烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,试写出其反应的离子方程式
▲ 。
查看答案和解析>>
科目: 来源: 题型:
T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
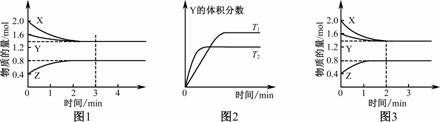
A. 反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
B. 容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
C. 保持其他条件不变,升高温度,反应的化学平衡常数K减小
D. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目: 来源: 题型:
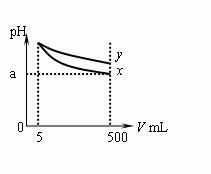
pH=11的x、y两种碱溶液各5 mL,分别稀释至500 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是
A.稀释后x溶液中水的电离程度比y溶液中水电离程度小
B.若x、y是一元碱,则等物质的量浓度的y的硝酸盐溶
液的pH比x的硝酸盐溶液小
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x、y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
查看答案和解析>>
科目: 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X是地壳中含量最多元素,Y原子最外层只有1个电子,Z原子最外层电子数是其电子层数的2倍。下列叙述一定正确的是
A.元素X的简单氢化物的沸点比Z简单氢化物的沸点高
B.X、Y元素形成的化合物的阴阳离子比为1:1或1:2
C.W的含氧酸的酸性强于Z的含氧酸的酸性
D.离子半径的大小顺序:rZ>rW>rX>rY
查看答案和解析>>
科目: 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无K+ |
| B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有 |
| C | 向一定浓度的CuSO4溶液中通入适量H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无 |
查看答案和解析>>
科目: 来源: 题型:
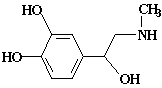
肾上激素是化学信使,随着血液走到身体各处,促使细胞发生变化。它的结构简式如下图。下列有关肾上激素的说法正确的是
A.分子式为C9H12NO3
B.该分子中至少有9个原子共平面
C.可以发生加成、氧化、消去、加聚反应
D.可以和NaOH溶液、Na2CO3溶液反应,也可以和盐酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com