
科目: 来源: 题型:
化合物甲与![]() 发生酯化反应的产物A是一种食用香料。11.6 g甲完全燃烧可产生0.6 mol CO2和0.6 mol H2O。相同条件下,甲蒸气对氢气的相对密度为29,甲分子为链状结构且不含甲基。回答下列问题:
发生酯化反应的产物A是一种食用香料。11.6 g甲完全燃烧可产生0.6 mol CO2和0.6 mol H2O。相同条件下,甲蒸气对氢气的相对密度为29,甲分子为链状结构且不含甲基。回答下列问题:
(1)甲的结构简式为__________________。
(2)甲中含有的官能团名称为______________。
(3) ![]() 有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为________________(任写两种)。
有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为________________(任写两种)。
(4)已知:R—ONa![]() R—O—R′(R—、R′—代表烃基)
R—O—R′(R—、R′—代表烃基)
A的合成路线如下:

①试剂X不可选用________(填序号)。
A.NaOH溶液 B.Na2CO3溶液 C.NaHCO3溶液 D.Na
②乙的结构简式为__________,反应Ⅱ的反应类型为________________。
③反应Ⅳ的化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡_______移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将__________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)__________pH(乙)(填“大于”、“小于”或“等于”)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)_________V(乙) (填“大于”、“小于”或“等于”)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)_________c(CH3COO-)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
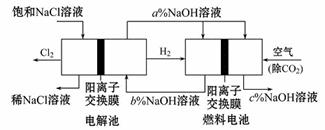
有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出):
回答下列有关问题:
(1)电解池的阴极反应式为_______________。
(2)通入空气的电极为_______________极
燃料电池中阳离子的移动方向_______(“从左向右”或“从右向左”)。
(3)电解池中产生2 mol Cl2,理论上燃料电池中消耗_____ mol O2。
(4)a、b、c的大小关系为:__________。
查看答案和解析>>
科目: 来源: 题型:
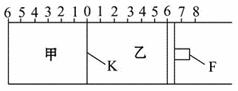
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
(1)达到平衡后隔板K是否可能处于0刻度_________(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a的最大值不会超过_________。
(2)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为______ mol,乙中SO3的转化率____50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度______处(填下列序号:①<6 ②>6 ③=6)。
(3)若一开始就将K、F固定,其他条件均不变,则平衡时,甲、乙中SO3的物质的量分数是甲______乙(填“>”、“<”或“=”);测得甲中SO2的转化率为w%,则乙中SO3的转化率等于_________。
(4)在上一小题中平衡后将甲容器的混合气体的1.0%通入足量Ba(NO3)2溶液,生成的BaSO4质量为_______克。
查看答案和解析>>
科目: 来源: 题型:
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。电池总反应为Zn+2MnO2+H2O===ZnO+2MnO(OH)。下列说法正确的是( )
A.电池正极反应式为2MnO2+2H2O+2e-===2MnO(OH)+2OH-
B.电池工作时,电子通过外电路从正极流向负极
C.当0.1 mol Zn完全溶解时,流经电解液的电子个数为1.204×1023
D.该电池反应中二氧化锰起催化作用
查看答案和解析>>
科目: 来源: 题型:
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-===AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
查看答案和解析>>
科目: 来源: 题型:
室温下,VaL pH=a的强酸与VbL pH=b的强碱溶液混合,混合后溶液pH=3。(混合前后体积变化忽略不计) 已知a+b=13,Vb=4.5Va,则a值为
A 1 B 2 C 3 D 4
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器中,N2、H2合成氨的反应已达到平衡。此时再往容器中通入一定量N2气体,保持温度和容器体积不变,当反应再次达到平衡时,与第一次平衡状态相比
A NH3的百分含量增大 B NH3的浓度增大
C H2的转化率不变 D N2的转化率提高
查看答案和解析>>
科目: 来源: 题型:
氢气与碘蒸气按1︰1体积比混和,使其在一定条件下反应,达到平衡时,碘化氢气体体积占反混合气体体积的50%,则反应混合气体中氢气所占的体积百分比是
A 50% B 33.3% C 25% D 20%
查看答案和解析>>
科目: 来源: 题型:
在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A vA=0.5mol/(L·s) B vB=0.5mol/(L·s)
C vC=0.8mol/(L·s) D vD=1mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com