
科目: 来源: 题型:
已知:H2O(g)= ==H2O(l) ΔH=Q1 kJ·mol-1 C2H5OH(g)===C2H5OH(l) ΔH=Q2 kJ·mol-1 C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3 kJ·mol-1 若使46 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 ( )
A.(Q1+Q2+Q3) kJ B.0.5(Q1+Q2+Q3) kJ
C . (0.5Q1-1.5Q2+0.5Q3) kJ D.(3Q1-Q2+Q3) kJ
查看答案和解析>>
科目: 来源: 题型:
已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1。
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为 ( )
A.+262.6 kJ·mol-1 B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1 D.+131.3 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
一些烷烃的燃烧热如下表:
| 化合物 | 燃烧热/kJ·mol-1 | 化合物 | 燃烧热/kJ·mol-1 |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2甲基丁烷 | 3 531.3 |
下列说法正确的是 ( )
A.正戊烷的燃烧热大约是3 540 kJ·mol-1 B.热稳定性:正丁烷>异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1560.8 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
科目: 来源: 题型:
在同温同压下,下列各组热化学方程式中,ΔH1>ΔH2的是 ( )
A.2H2(g)+O2(l)===2H2O(l) ΔH1 2H2(g)+O2(g)===2H2O(g) ΔH2
B.S(g)+O2(g)===SO2(g) ΔH1 S(s)+O2(g)===SO2(g) ΔH2
C.C(s)+![]() O2(g)===CO(g) ΔH1 C(s)+O2(g)===CO2(g) ΔH2
O2(g)===CO(g) ΔH1 C(s)+O2(g)===CO2(g) ΔH2
D.H2(g)+Cl2(g)===2HCl(g) ΔH1 ![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH2
Cl2(g)===HCl(g) ΔH2
查看答案和解析>>
科目: 来源: 题型:
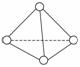
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则 ( )
A.N4的熔点比P4高 B.N4是N2的同系物
C.1 mol N4气体转化为N2时要吸收724 kJ能量
D.1 mol N4气体转化为N2时要放出724 kJ能量
查看答案和解析>>
科目: 来源: 题型:
已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ,下列关系式正确的是 ( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.Q1+Q2<Q3 D.Q1+Q2<2Q3
查看答案和解析>>
科目: 来源: 题型:
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如 下图所示。反应温度过高时,Ti元素浸出率下降的原因是 。

(5)反应③的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
某混合溶液中,只可能大量含有下表所列离子中的某几种:
| 阳离子 | H+、K+、 |
| 阴离子 |
|
将Na2O2逐渐加入到上述混合溶液中,产生沉淀的物质的量与加入Na2O2的物质的量的关系如图所示。

(1)将上述混合溶液中一定大量含有的阴、阳离子及其物质的量填入下表(可以不填满,也可以增加)。
| 离子种类 | ||||||
| 物质的量(mol) |
(2)图中a=_________,b=_________。
查看答案和解析>>
科目: 来源: 题型:
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。

请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是__________;
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为______________________________________
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是___________________________________________________。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为_________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的
Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH  B.分别在两种溶液中滴加甲基橙
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别 D. 用AgNO3和HNO3两种试剂来别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为
Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com