
科目: 来源: 题型:
配制一定物质的量浓度的KOH溶液时,造成实验结果偏低的原因是 ( )
A.容量瓶中原有少量蒸馏水 B.洗涤烧杯和玻棒的溶液转入容量瓶中;
C.定容时俯视液面 D.定容时仰视液面
查看答案和解析>>
科目: 来源: 题型:
某溶液中含有HCO3-、Na+、CO32-、CH3COO-4种离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化) ( )
A.CH3COO- B.Na+ C.CO32- D.HCO3-
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是( )
A.区别胶体与溶液的最本质的特征是丁达尔效应
B.胶体中分散质粒子直径小于1×10-9m
C.往NaOH溶液中滴入FeCl3溶液立即可制得胶体
D.清晨的阳光穿过茂密的树木枝叶所产生的美丽景象(美丽的光线)是由于胶体粒子对光线的散射形成的。
查看答案和解析>>
科目: 来源: 题型:
A是一种药用有机物,在生活中有较高的用途.A的转化关系如下图所示。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基处于邻位,D能跟NaOH溶液反应。

请回答:
(1)A转化为B、C时.涉及到的反应类型有_____________、__________________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q_______________、R______________。
(3)D的结构简式为________________。
(4)写出A在加热条件下与NaOH溶液反应的化学方程式
______________________________________________________。
(5)已知:![]() 。请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。
。请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。

查看答案和解析>>
科目: 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,
 可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2 NH3(g)+CO2(g) ![]() NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
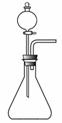
(1)如用右图装置制取氨气,你所选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 。液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 真空40 ℃以下烘干
③尾气处理装置如右图所示。双通玻璃管的作用: ;
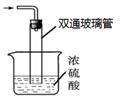 浓硫酸的作用: 、 。
浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,
用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过
滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸
铵的物质的量分数为 。
[Mr(NH2COONH4)=78g/mol、Mr(NH4HCO3) =79 g/mol、Mr(CaCO3)=100 g/mol]
查看答案和解析>>
科目: 来源: 题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
(1)硫酸生产中,SO2催化氧化生成SO3;
 2SO2(g)+O2(g)
2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
①2SO2(g)+O2(g)![]() 2SO3(g)的△H 0(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通人氦气,平衡 移动(填“向左” 或“向右”)
2SO3(g)的△H 0(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通人氦气,平衡 移动(填“向左” 或“向右”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;反应进行到状态D时,![]()
![]() (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
①如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:
(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水,在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=“);用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数 .
(3)海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。已知25℃时KSP(AgCl)=1.6×l0-10 mol2·L-2 KSP(AgI)=1.5×l0-16 mol2·L-2 。在25℃下,向0.1L 0.002mol·L-l的NaCl溶液中加入0.1L 0.002mol·L-l硝酸银溶液,有白色沉淀生成,从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com