
科目: 来源: 题型:
已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是 ( )
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液
MgCl2溶液![]() MgCl2熔融
MgCl2熔融![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液 ![]() MgCl2熔融
MgCl2熔融![]() Mg
Mg
查看答案和解析>>
科目: 来源: 题型:
下列实验结论不正确的是 ( )
| 实验操作 | 现象 | 结论 | |
| A | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 | 溶液褪色 | 产物不都是烷烃 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O4)溶液(溶液显橙色)混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 将碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀( | 葡萄糖具有还原性 |
查看答案和解析>>
科目: 来源: 题型:
下列关于苯的叙述正确的是 ( )

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
科目: 来源: 题型:
下列不能说明氯的非金属性比硫强的事实是 ( )
①HCl比H2S稳定 ②HCl和H2S的水溶液前者的的酸性强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A. ①②④ B.① ②⑥ C. ②⑤ D.①③⑤
查看答案和解析>>
科目: 来源: 题型:
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是
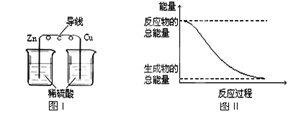
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.铝热反应中, 反应物的总能量比生成物的总能量低
C.图I所示的装置能将化学能转变为电能
D.图II所示的反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W是原子序数依次递增的4种短周期元素。其中X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z原子的L层电子数比K层与M层电子数之和多5个,W在同周期元素中非金属性最强。下列说法正确的是( )
A. X、Y、Z 3种元素组成的化合物中阴、阳离子所含电子数不等
B. X与Z为同主族元素,它们的单质与W单质反应均失去电子
C. Y、Z、W 3种元素组成的某种化合物可用于消毒
D. Y与Z的单质在常温下反应生成Z2Y2
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是 ( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
A.①③⑤ B.②④⑤ C.②③④ D.①③
查看答案和解析>>
科目: 来源: 题型:
 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。(1)下列________(填写编号)组元素的单质可能都是电的良导体。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h②b、g、k③c、h、l④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响: A.原子核对核外电子的吸引力 B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
① 通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量___________________________________________。
② 表中X可能为以上13种元素中的(填写字母)________元素。用元素符号表示X和j形成化合物的化学式____________________。
③ Y是周期表中________族元素。
以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目: 来源: 题型:
W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:
。
查看答案和解析>>
科目: 来源: 题型:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布msnmpn ③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是__________________________________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(3)Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com