
科目: 来源: 题型:
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 ,写出与CO互为等电子体的一种离子的化学式为 。
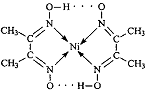 (2)右图配合物分子内的作用力除共价键外,还存在的两种作用 力是 (填编号)。
(2)右图配合物分子内的作用力除共价键外,还存在的两种作用 力是 (填编号)。
A.氢键 B.离子键 C. 范德华力 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。
如:①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
(4)Mn、Fe和Ni一样均为第四周期过渡元素,两元素的部分电离能数据如下表。
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
据此分析Mn2+比Fe2+ (填 “更易” 或“更难 ”)再失去-个电子,从微粒结构的角度简述其原因是 。
(5)NiO的晶体结构类型与氯化钠的相同,NiO晶胞中与Ni最近的Ni的数目为 个。
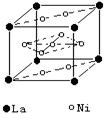 (6)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上。该晶体的化学式是______。
(6)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上。该晶体的化学式是______。
查看答案和解析>>
科目: 来源: 题型:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
 |
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(1)实验过程中,使用分液漏斗滴加液体的操作是
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为
是否可行? (填“可行”或“不可行”),原因是
(3)实验Ⅱ中量气管中的液体最好是__ __(填字母编号,下同)
A.浓NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,不能防止倒吸的是 .
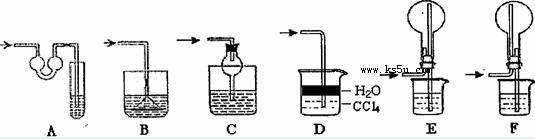
(4)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,② ,③视线与凹液面最低处相平.
(5)写出实验Ⅲ中涉及的离子反应方程式
(6)实验Ⅲ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为__ __.
查看答案和解析>>
科目: 来源: 题型:
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤。
(1)某温度下,SO2(g)+![]() O2(g)
O2(g)![]() SO3(g)△H=-98 kJ·mol-1。开始时在
SO3(g)△H=-98 kJ·mol-1。开始时在
100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
 (3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2 的电极的电极反应式: 。检验其中产物有SO42-的具体操作为 。
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2 的电极的电极反应式: 。检验其中产物有SO42-的具体操作为 。
(4)常温时,BaSO4的Ksp==1.08x10-10.现将等体积的BaCl2溶液与2.0x10-3mol/l的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为______________。
(5)下列关于2SO2(g)+O2(g)![]() 2SO3(g)反应的图像中,正确的是 。
2SO3(g)反应的图像中,正确的是 。

(6)SO2有氧化性又有还原性,还有漂白性。将SO2气体通入酸性KMnO4中,酸性KMnO4褪色,其中SO2体现出的性质是 。
查看答案和解析>>
科目: 来源: 题型:
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的化学式:
A J
(2)按要求写方程式:
①C转化为I的离子方程式: 。
②F在空气中转化为G的化学方程式: 。
③D可以与水蒸气在高温条件下反应,写出此反应的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
现有四种短周期元素的原子半径及主要化合价数据如下表所示:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
下列叙述不正确的是( )
A.甲单质的熔点比丙单质的熔点高
B.甲单质可用电解其熔融盐的方法冶炼而得
C.常温下,丁的两种氢化物均为液体
D.乙的简单离子是四种元素各自形成的简单离子中半径最大的
查看答案和解析>>
科目: 来源: 题型:
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a = b B.混合溶液的PH=7
C.混合溶液中,c(H+)=![]() D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
查看答案和解析>>
科目: 来源: 题型:
实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
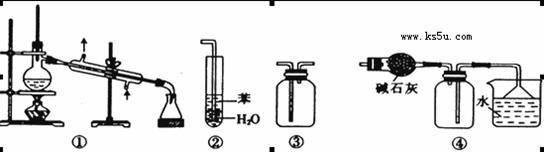
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置③可用于收集H2、CO2、Cl2、NH3等气体
D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目: 来源: 题型:
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是:( )
A.常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性
B.已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强
C.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O)
D.常温下,pH均为5的醋酸和硫酸铝溶液,由水电离出的氢离子浓度均为1×10-9 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是( )
A. 正极反应式:Ag+Cl--e-=AgCl B. 每生成1 mol Na2Mn5O10转移2 mol电子
C. Na+不断向“水”电池的负极移动 D. AgCl是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com