
科目: 来源: 题型:
下列事实不能用勒夏特列原理解释的是
A.往氢硫酸溶液中加入烧碱,有利于c(S2-)增大
B.经粉碎的黄铁矿燃烧得较快、较完全
C.实验室用排饱和食盐水的方法收集氯气
D.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率
查看答案和解析>>
科目: 来源: 题型:
下列强电解质、弱电解质、非电解质的分类,正确的一组是
| 组别 | A | B | C | D |
| 强电解质 | CH3COOH | NaOH | CuSO4 | HCl |
| 弱电解质 | Al | NH3·H2O | CaCO3 | CH3COOH |
| 非电解质 | CO2 | 酒精 | 水银 | 金刚石 |
查看答案和解析>>
科目: 来源: 题型:
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体的流向,B处出来的气体主要为
A.O2 、SO2、SO3 B.SO2、 O2
C.SO2、SO3 D.SO3、O2

查看答案和解析>>
科目: 来源: 题型:
将![]() mol/L的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,错误的是
mol/L的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,错误的是
A.电离程度增大 B.溶液中离子总数增多
C.溶液导电性增强 D.溶液中醋酸分子减少
查看答案和解析>>
科目: 来源: 题型:
能用离子方程式H++OH- → H2O表示的反应是
A.稀醋酸和稀氨水反应 B.稀硫酸和烧碱溶液反应
C.稀盐酸和氢氧化铜反应 D.稀硫酸和氢氧化钡溶液反应
查看答案和解析>>
科目: 来源: 题型:
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验数据见表:
2NH3(g)+CO2(g)。实验数据见表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是___________。
A.2v(NH3) = v(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中混合气体的密度不变 D.密闭容器中总压强不变
②根据表中数据计算,25.0℃时该反应的分解平衡常数K=_________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
④氨基甲酸铵分解反应的焓变△H 0,熵变△S 0(填>、<或=)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
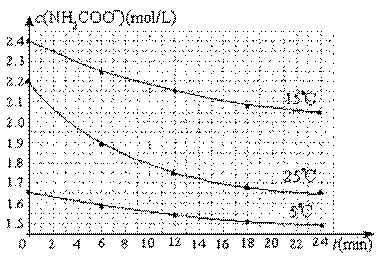
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:
____ ____。
查看答案和解析>>
科目: 来源: 题型:
一定温度下在体积为5 L的密闭容器中投入原料发生反应。
Ⅰ.若某可逆反应的化学平衡常数表达式为:![]()
写出该反应的化学方程式: ;
Ⅱ.若该密闭容器中加入的是2molFe(s)与1mol H2O(g)可以生成Fe3O4(s)与H2(g)。t1秒时,测得H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。
(1) t1~t2这段时间内的化学反应速率v(H2)= 。
 |
(3) 若继续加入2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1mol H2O(g) 再次达到平衡后,H2的物质的量为
mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com