
科目: 来源: 题型:
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是
;调溶液pH的目的是使 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:
Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目: 来源: 题型:
下列转化关系所涉及的物质都是中学化学常见物质。已知A、B为氧化物,C为固体单质,D为黄绿色气体。
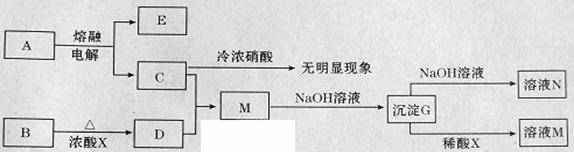
请回答:
(1)指出A中存在的化学键类型: 。
(2)写出M与过量氨水反应的离子方程式: 。
(3)向溶液N中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是
_____________ ________。
(4)电解熔融氧化物A,阳极的电极反应方程式为 。
(5)B与浓酸X反应的化学方程式为 。
(6)能不能直接蒸发溶液M得到M晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
查看答案和解析>>
科目: 来源: 题型:
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足
量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
⑴提出问题:Fe3+、Br2谁的氧化性更强?
⑵猜想;①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则
溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含 所致。
⑶设计实验并验证
丙同学为验证乙同学的观点,选用下列 某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到得现象。(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
⑷结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为: 。
⑸实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先氧化的离子是 (填离子符号)。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有![]() 的Br-被氧化成单质Br2,则原FeBr2溶中FeBr2的物质的量浓度为 。
的Br-被氧化成单质Br2,则原FeBr2溶中FeBr2的物质的量浓度为 。
查看答案和解析>>
科目: 来源: 题型:
某无色溶液,由Na+、Ag+、Ba2+、Al3+、[Al(OH)4]-(或AlO2-)、MnO4-、
CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
A、取适量试液,加入过量盐酸,有气体生成,并得到溶液;
B、在A所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
C、在B所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
⑴溶液中一定不存在的离子是 ;
⑵一定存在离子是 ;
⑶判断沉淀乙成分的方法是 。
查看答案和解析>>
科目: 来源: 题型:
实验室配制500mL0.2mol·L-1的FeSO4溶液,具体操作步骤为:
①在天平上称取一定质量的绿矾(FeSO4·7H2O),把它放在烧杯中,用适量的蒸馏水使其完全
溶解;
②把制得的溶液小心的注入500mL的容量瓶中;
③继续向容量瓶中滴加蒸馏水至液面距刻度线1~2cm处时,改用胶头滴管小心滴加,直到
溶液的凹液面恰好与刻度线相切为止;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都转入容量瓶中,并轻轻摇匀;
⑤将容量瓶塞好,充分摇匀。 请填写下列空白。
⑴用托盘天平称取的绿矾的质量为: ;
⑵上述操作的正确顺序为: ;
⑶本次实验用到的仪器有:玻璃棒、 ,
在配制溶液的过程中多次用到玻璃棒,在溶解时玻璃棒的作用是: ,
在移液时玻璃棒的作用是: 。
⑷观察液面时,若俯视刻度线,会使所配制的溶液的浓度 (填“偏高”、“偏低”
或“无影响”下同);加蒸馏水时不慎超过了刻度线后倒出部分溶液,使液面与刻度线相切,
会 ;
⑸用ρ=1.84g·mL-1,质量分数为98%的浓硫酸配制200mL1mol·L-1的稀硫酸与上述配制溶液的步骤上的差别主要有三点:
①计算:理论上应取浓硫酸的体积V= mL(精确到小数点后两位);
②量取:由于量筒是一种粗略的量具,如想精确量取,必需选用 (填仪器名称)。
③溶解:稀释浓硫酸的方法
。
查看答案和解析>>
科目: 来源: 题型:
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是( )
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+ B.V=224
C.样品中CuO的质量为4.0g D.V=448
查看答案和解析>>
科目: 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是 ( )
A.开始加入合金的质量可能为16.4g
B.参加反应的硝酸的物质的量为0.1mol
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.标况下产物NO的体积为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com