
科目: 来源: 题型:
室温时,下列各组离子在指定溶液中可以大量共存的是
A. 1.0mol/L的KNO3溶液:H+,Fe2+ ,K+,SO42-
B. 由水电离出 c(H+)=1.0×10-13的溶液:Na+,CH3COO-,HCO3-,SO42-
C. 加入甲基橙试液呈红色的溶液:NH4+,K+,SO42-,Cl-
D. 饱和氯水中:NO3-,Na+,SO32-,Cl-
查看答案和解析>>
科目: 来源: 题型:
NA表示阿伏加德罗常数,下列叙述不正确的是
A. 常温常压下, CO2和CO混合气体1mol中含有的碳原子数为NA
B. 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol I2,则转移6NA个电子
C. 1mol Na2O2与H2O完全反应,转移的电子总数为NA
D. 在1L0.1mol/L的碳酸钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
科目: 来源: 题型:
海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是
A.海水蒸发制海盐的过程只发生了化学变化
B.海水中含有钾元素,只需要经过物理变化就可以得到钾单质
C.利用潮汐发电是将化学能转化为电能
D.从海水中提取溴单质的过程涉及氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A. 增大反应体系的压强,反应速率一定增大
B. 化学键既存在于分子中相邻原子间,也存在于相邻分子的原子间
C. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
查看答案和解析>>
科目: 来源: 题型:
关于下列各实验装置的叙述中,不正确的是
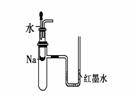
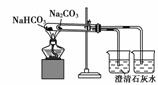
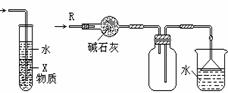
① ② ③ ④
A.装置①可用于验证Na与H2O反应是否放热
B.装置②可用于比较Na2CO3与NaHCO3的稳定性
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是
A. 化石燃料燃烧产生大量CO2,会导致温室效应
B. 自来水可用氯气来杀菌消毒,说明氯气无毒
C. 血液透析利用了胶体的性质
D. 采用原煤脱硫技术,可减少燃煤燃烧时产生的SO2
查看答案和解析>>
科目: 来源: 题型:
为了探究原电池和电解池的工作原理,某研究性学习小组分别用图14所示的装置进行实验。据图回答问题。
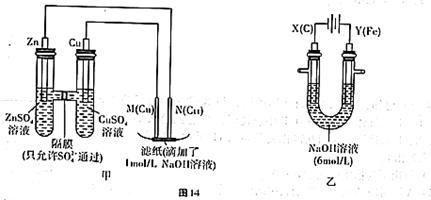
I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
A.石墨 B.镁 C.银 D.铂
(2)实验过程中,SO42— (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸银(![]() )在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH--4e-=2H2O+O2↑和 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
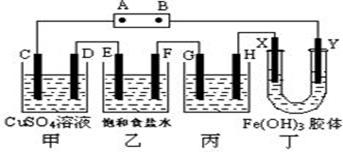
(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:___________ _____。
(3)设电解质溶液过量,则同一时间内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
(5)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为 mol/L。
查看答案和解析>>
科目: 来源: 题型:阅读理解
I、已知反应:
3I-(aq)+S2O82-(aq) ![]() I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)写出反应的平衡常数表达式
 K= 。
K= 。
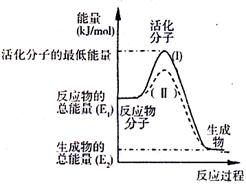
(2)右图表示反应过程中有关物质的能量,则反应
的 △H 0(填>、<、=)。
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol·L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
II、二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。
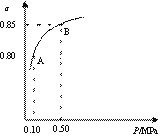 根据图示回答下列问题。
根据图示回答下列问题。
①平衡状态由A变到B时,平衡常数K(A) K(B)
(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,
在体积不变的条件下,下列选项中有利于提高SO2平衡转
化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.移出氧气
查看答案和解析>>
科目: 来源: 题型:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g) + 2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
⑴ 该反应的平衡常数表达式为
K = _______________________。
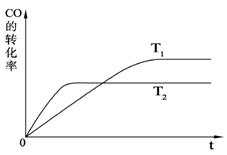
⑵ 右图是该反应在不同温度下CO的转化率随时间变化的曲线。
① 该反应的焓变△H _____0(填“>”、“<”或“=”)。
② 若容器容积不变,下列措施可增加甲醇产率的是_________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D![]() .充入He,使体系总压强增大
.充入He,使体系总压强增大
⑶ 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) △H=-a kJ·mol-1
② 2CO(g) + O2(g) = 2CO2(g) △H=-b kJ·mol-1
③ H2O(g) = H2O(l) △H=-c kJ·mol-1
则CH3OH(l) + O2(g) = CO(g) + 2H2O(![]() l) △H = ____________________ kJ·mol-1。
l) △H = ____________________ kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com