
科目: 来源: 题型:
NA代表阿伏加德常数,下列说法正确的是( )
A. 在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.标准状况下,22.4LH2O含有的分子数为1 NA
C.在常温常压下,11.2L氮气所含的原子数目为NA
D.1.8g的NH4+离子中含有的电子数为 NA
查看答案和解析>>
科目: 来源: 题型:
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( )
![]()
![]()
![]()
![]()
A. 蒸馏、蒸发、萃取、过滤 B. 蒸馏、过滤、萃取、蒸发
C. 萃取、过滤、蒸馏、蒸发 D. 过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目: 来源: 题型:
下列叙述中,正确的是 ( )
A.12g碳所含的碳原子数就是阿伏加德罗常数
B.氦气的摩尔质量是8g
C.阿伏加德罗常数通常用NA表示,6.02×1023 mol-1称为阿伏加德罗常数
D.4.4g二氧化碳气体中所含的原子个数与4.2g氮气中所含的原子个数相等
查看答案和解析>>
科目: 来源: 题型:
下图所示是用于气体制备、干燥(或除杂质)、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去,各装置可以不用,但不可重复使用,)。请根据下列要求回答问题。
 E
E
(1) 若用A-D-B-E组合进行探究氨气与氧化铜的反应,则分液漏斗中应加入的试剂是 , E装置的作用 。
(2) 为了进行氨的催化氧化实验,若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是(填字母) ;装置B中发生反应的化学方程式为: 。
(3) 若用A-C-D-B组合进行氢气还原氧化铜实验。分液漏斗中的试剂是盐酸,C中试剂是水,其作用是 ;A中反应开始后,加热B之前的实验操作是 ,加热后B中将观察到的现象是 。
查看答案和解析>>
科目: 来源: 题型:
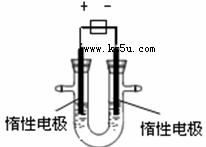
(1)用惰性电极电解CuSO4溶液(如右图的装置),
该过程中电解池电极反应式为是阳极: ,阴极: 。
(2)若电解池中装入足量溶液,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为 (假设气体全部逸出)。
(3)欲使电解液恢复到起始状态,应向溶液中加入适量的
A.CuSO4 B.H2O C.CuO D.CuSO4·5H2O
查看答案和解析>>
科目: 来源: 题型:
(1)今有2H2+O2 == 2H2O 反应,构成燃料电池
①负极通的应是 ,正极通的应是 ,电极反应式为:负极 ;正极 。
②若把KOH改为硫酸,电极反应式为:负极 ;正极 。
③若把H2改为CH4,KOH作电解质,则电极反应式为:负极 。
(2)铅蓄电池是典型的可充电型电池 Pb+PbO2+2H2SO42PbSO4+2H2O
①铅蓄电池放电时,负极的电极反应式为 。
②当外电路通过2mol电子时,电解液中硫酸的物质的量将减少 mol。
查看答案和解析>>
科目: 来源: 题型:
(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)![]() 2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃ K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃ K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
①写出该反应的平衡常数表达式:K=____________。
②1000s内N2O5的分解速率为:_____________。
③若每有1 mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式
。
④能使4NO2(g)+O2(g)![]() 2N2O5(g)反应速率增大,且平衡向正反应方向移动的是
2N2O5(g)反应速率增大,且平衡向正反应方向移动的是
a . 及时分离出N2O5 b . 适当提高温度 c . 增大O2浓度 d . 选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
回答和氯有关的问题:
(1)在标准状况下,35.5g氯气的体积是___________,将其与氢气完全化合,需氢气的物质的量是 ,将生成的气体制成1L溶液,溶质的物质的量浓度是______。
(2)标准状况下,a L氢气在过量的bL氯气中充分燃烧,所得混合物溶于水中,所得溶液具有漂白性是因为含有(写化学式) ,加入100mL3.00mol/L的NaOH溶液恰好完全反应,则氯气的体积b=
查看答案和解析>>
科目: 来源: 题型:
已知:3Fe2++ NO3-+4H+= 3Fe3++ NO↑+2H2O,对于该反应的下列叙述中,不正确的是
A.氧化剂和还原剂的物质的量之比为1∶3
B.离子间的反应说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO3-发生氧化反应,转移3 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+- e-=Fe3+
查看答案和解析>>
科目: 来源: 题型:
一定温度下,恒容密闭容器中可逆反应H2(g)+I2(g) ![]() 2 HI (g)达到平衡状态的标志是
2 HI (g)达到平衡状态的标志是
A.混合气体的压强不再变化
B.反应速率v(H2) = v(HI)/2
C.混合气体的颜色不再变化
D.c(H2):c (I2): c(HI)= 1:1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com